Пептидний зв’язок: утворення, будова, властивості
Зміст:
Саме пептидний зв’язок є основою побудови всіх білкових молекул, з яких, в кінцевому рахунку, утворюється вся жива матерія. Особливості будови пептидного зв’язку, його структура справили величезний вплив на саму можливість існування життя на нашій планеті. Про те, що таке пептидний зв’язок, як він утворюється і якими властивостями володіє, читайте далі.
Визначення
Пептидний зв’язок це зв’язок, що виникає між амінокислотами при взаємодії аміногрупи (-NH2) та карбоксильної групи (-COOH). Дві з’єднані одна з іншого кислоти утворюють дипептид, три – трипепетид і так далі. Довгі ланцюги подібного роду звуться поліпептидами і білками.
Також академічне визначення пептидного зв’язку звучить так: пептидний зв’язок – це вид хімічного зв’язку, що виникає внаслідок взаємодії α-аміногрупи однієї амінокислоти і α-карбоксигрупи іншої амінокислоти.
Саме ж слово «пептид» походить від грецького «поживний» і означає сімейство речовин, молекули яких побудовані з двох або більше залишків амінокислот, з’єднаних в ланцюг пептидними зв’язками -C (O) NH-.
Утворення
Як утворюється пептидний зв’язок? Утворення пептидного зв’язку відбувається всередині клітин на рибосомах за активної участі ферментів з витратою енергії. Амінокислоти при цьому, будучи мономерами, грають роль таких собі будівельних блоків білків. Для синтезу білка живими організмами використовується 20 видів різних амінокислот.
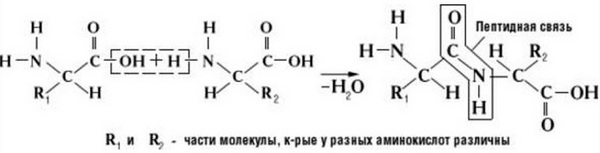
Що ж стосується самого процесу утворення пептидного зв’язку між амінокислотами, то він утворюється при відтягуванні електронної щільності з атома водню аміногрупи однієї амінокислоти і атомом кисню карбоксильної групи іншої амінокислоти.
Ось так процес утворення пептидного зв’язку в молекулі виглядає схематично.
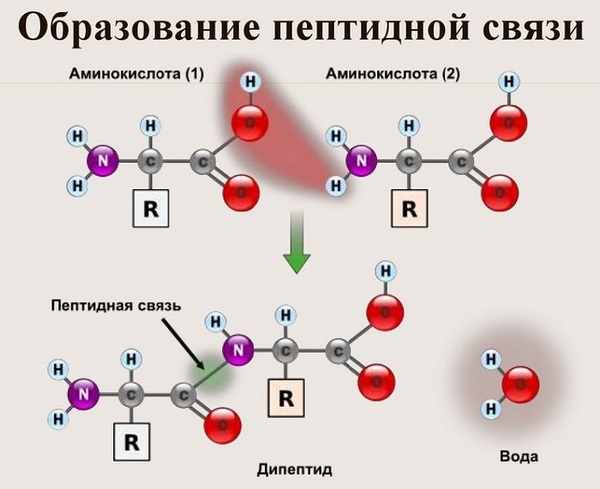
Як наслідок розриваються з’єднання між N і H в аміногрупі і між C і OH в карбоксильній групі. З’єднання протона та гідроксильної групи в результаті утворює воду, а два амінокислотних залишки – дипептид.
Властивості
Пептидний зв’язок, який має місце при первинній структурі білків, не є повністю одинарним. Довжина його дорівнює 0,132 нм. Це середнє значення між істинним подвійним та одинарним зв’язками.
Важливими властивостями пептидного зв’язку є копланарність та трансположення, далі докладно їх пояснимо.
Копланарність означає, що всі атоми, що входять в пептидну групу знаходяться на одній площині, а атоми H і О розташовуються по різні боки від пептидного зв’язку. Але варто зауважити, що радикальні групи амінокислот і водню при α-вуглецю лежать за межами площини.
Трансположення означає, що кисень і водень пептидного зв’язку знаходяться в транс-орієнтації. Також в транс-орієнтації орієнтовані амінокислотні R-групи у всіх білкових і пептидних молекулах природного походження.
Будова
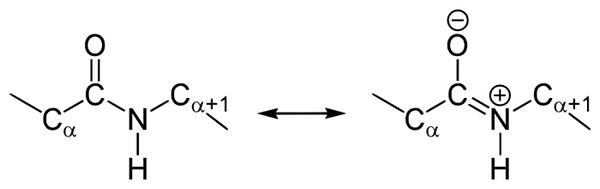
У чому особливості будови пептидного зв’язку? В амідній групі -CO-NH- вуглецевий атом існує у формі sp2-гібридизації. Наприклад, електронна пара атома азоту сполучається з π-електронами подвійного зв’язку між вуглецем і киснем. Тоді електронна щільність пептидної групи зміститься до кисню. В результаті подібного сполучення вирівняються довжини зв’язків всередині радикала.
Структура подібного пептидного зв’язку і формула відображена на зображенні.
Методи визначення
Найкращим методом для визначення пептидних зв’язків є біуретова реакція. Таку назву вона має тому, що вперше ця реакція була використана для отримання біурета, який хоча і не є амінокислотою, але володіє при цьому двома пептидними зв’язками.
Сам механізм визначення зводиться до того, що амінокислоти, здатні утворити як мінімум два пептидні зв’язки в лужному середовищі при додаванні сульфату міді утворюють комплексне з’єднання фіолетового кольору з домішкою міді.
Рекомендована література та корисні посилання
- Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983 “. European Journal of Biochemistry. 138 (1): 9-37. 1984. doi: 10.1111 / j.1432-1033.1984.tb07877.x. ISSN 0014-2956.
- Muller, P (1994-01-01). “Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077-1184. doi: 10.1351 / pac199466051077. ISSN 1365-3075.
- Watson J, Hopkins N, Roberts J, Agetsinger Steitz J, Weiner A (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin / Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- Miller BR, Gulick AM (2016). “Structural Biology of Nonribosomal Peptide Synthetases”. Methods in Molecular Biology. 1401: 3-29. doi: 10.1007 / 978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
- Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.

