Пептидная связь: образование, строение, свойства
Содержание:
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Определение
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
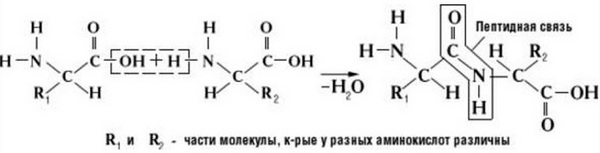
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
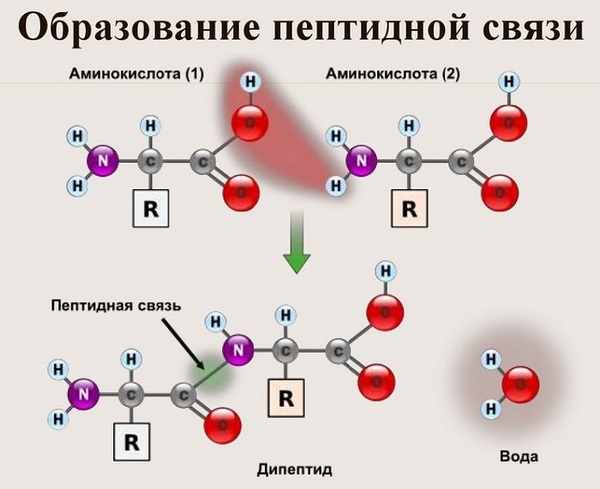
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение
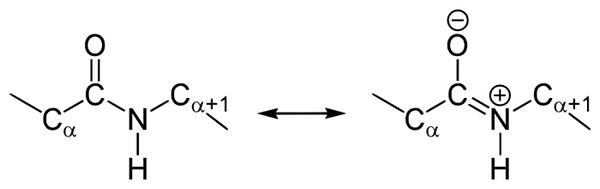
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp2-гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
- Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983″. European Journal of Biochemistry. 138 (1): 9–37. 1984. doi:10.1111/j.1432-1033.1984.tb07877.x. ISSN 0014-2956.
- Muller, P (1994-01-01). «Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)». Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. ISSN 1365-3075.
- Watson J, Hopkins N, Roberts J, Agetsinger Steitz J, Weiner A (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- Miller BR, Gulick AM (2016). «Structural Biology of Nonribosomal Peptide Synthetases». Methods in Molecular Biology. 1401: 3–29. doi:10.1007/978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
- Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.

