Хімічний зв’язок: визначення, типи, властивості
Зміст:
Хімічний зв’язок, його типи, властивості, поряд з хімічними реакціями є одним з наріжних каменів цікавої науки під назвою хімія. У цій статті ми розберемо всі аспекти хімічних зв’язків, їх значення в науці, приведемо приклади і багато іншого.
Визначення
Під хімічним зв’язком в хімії розуміється взаємне зчеплення атомів в молекулі і кристалічній решітці, в результаті дії сили тяжіння, що існує між атомами. Саме завдяки хімічним зв’язкам відбувається утворення різних хімічних сполук, в цьому полягає природа хімічного зв’язку.
Типи зв’язків
Механізм утворення хімічного зв’язку сильно залежить від його типу або виду, в цілому розрізняються такі основні види хімічного зв’язку:
- Ковалентний хімічний зв’язок (який в свою чергу може бути полярним і неполярним)
- Іонний зв’язок
- Водневий зв’язок
- Хімічний зв’язок металів
Що стосується ковалентного хімічного зв’язку, то на нашому сайті йому присвячена окрема стаття, і більш детально ви можете почитати за посиланням. Далі ж ми розберемо більш детально всі інші основні типи хімічних зв’язків.
Іонний зв’язок
Утворення іонного хімічного зв’язку виникає при взаємному електричному тяжінні двох іонів, що мають різні заряди. Іони зазвичай при таких хімічних зв’язках прості, що складаються з одного атома речовини.
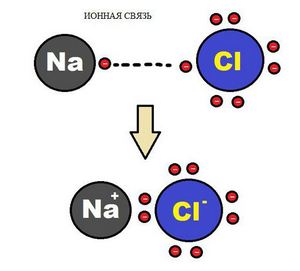
Схема іонного хімічного зв’язку.
Характерною особливістю іонного типу хімічного зв’язку є відсутність у нього насиченості, і як результат, до іона або навіть цілої групи іонів може приєднатися сама різне кількість протилежно заряджених іонів. Прикладом іонного хімічного зв’язку може служити з’єднання фториду цезію CsF, в якому рівень «іоності» становить практично 97%.
Водневий зв’язок
Ще задовго до появи сучасної теорії хімічних зв’язків в її сучасному вигляді вченими хіміками було помічено, що з’єднання водню з неметалами володіють різними надзвичайними властивостями. Скажімо, температура кипіння води і разом зі фтороводнем набагато вище, ніж це могло б бути, ось вам готовий приклад водневого хімічного зв’язку.
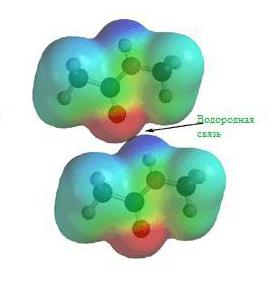
На зображенні схема утворення водневого хімічного зв’язку.
Природа і властивості водневого хімічного зв’язку обумовлені здатністю атома водню H утворювати ще один хімічний зв’язок, звідси власне і назва цього зв’язку. Причиною утворення такого зв’язку є властивості електростатичних сил. Наприклад, загальна електронна хмара в молекулі фтороводню настільки зміщена в бік фтору, що простір навколо атома цієї речовини насичений негативним електричним полем. Навколо атома водню, тим більше позбавленого свого єдиного електрона, все з точністю до навпаки, його електричне поле значно слабше і як наслідок має позитивний заряд. А позитивні і негативні заряди, як відомо, притягуються, таким нехитрим чином і виникає водневий зв’язок.
Зв’язок металів
Який хімічний зв’язок характерний для металів? У цих речовин є свій власний тип хімічного зв’язку – атоми всіх металів розташовані не аби як, а певним чином, порядок їх розташування називається кристалічною решіткою. Електрони різних атомів утворюють загальну електронну хмару, при цьому вони слабо взаємодіють один з одним.
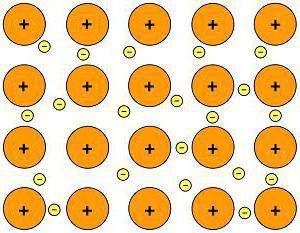
Так виглядає металевий хімічний зв’язок.
Як приклад металевого хімічного зв’язку можуть виступати будь-які метали: натрій, залізо, цинк і так далі.
Як визначити вид зв’язку
Залежно від речовин, які беруть у ній участь, якщо метал і неметал, то зв’язок іонний, якщо два метали, то металевий, якщо два неметали то ковалентний.
Властивості зв’язків
Щоб провести порівняння різних хімічних реакцій використовуються різні кількісні характеристики, такі як:
- довжина,
- енергія,
- полярність,
- порядок зв’язків.
Розберемо їх докладніше.
Довжина зв’язку – рівноважна відстань між ядрами атомів, які з’єднані хімічним зв’язком. Зазвичай вимірюється експериментально.
Енергія хімічного зв’язку визначає її міцність. В даному випадку під енергією мається на увазі зусилля, необхідне, для того, щоб розірвати хімічний зв’язок і роз’єднати атоми.
Полярність хімічного зв’язку показує, наскільки електронна щільність зміщена до одного з атомів. Здатність атомів зміщувати до себе електронну щільність або кажучи простою мовою «тягнути ковдру на себе» в хімії називають електронегативністю.
Порядок хімічного зв’язку (іншими словами кратність хімічного зв’язку) – це число електронних пар, що вступають в хімічний зв’язок. Порядок може бути, як цілим, так і дробовим, чим він вищий, тим більше число електронів здійснюють хімічний зв’язок і тим важче його розірвати.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.
Ця стаття доступна англійською мовою – Chemical Bonding: Definition, Types, Properties.


Дякую за інформацію
Спасибо!
Это очень помогло
дякую, дуже пізнавально.