Каталіз і ферменти – містки через неживе
Ми звикли до того, що все в наш час розвивається гігантськими темпами. Стрімко зростають усілякі швидкості: руху, виробництва, наукової інформації, технологічних процесів. Ми звикли до цього і часто навіть не помічаємо змін, які відбулися в нашому житті за останні п’ять — десять років. Проблем і витрат, пов’язаних з сучасним технологічним розвитком людства, багато. Одна з найбільш грізних – забруднення навколишнього середовища, інша – обмеженість природних ресурсів.
Ми, хіміки, усвідомлюємо ці проблеми особливо гостро. Працею кількох поколінь хіміків створена сучасна індустрія великомасштабної трансформації молекул – хімічна технологія. З нею пов’язані багато, і кращі і гірші, сторони сучасного життя. Коли знаходишся на сучасному хімічному виробництві і спостерігаєш за роботою установки, що переробляє десять мільйонів тонн (!) речовини в рік, розумієш, що проблеми сировини і забруднення навколишнього середовища не висмоктані з пальця.
І все-таки створення потужних хімічних виробництв – життєва необхідність. Розвиток суспільства безперервно вимагає нових матеріалів, добрив, палива у все більшій кількості.
Проблема, яка повинна бути вирішена, формулюється досить просто – розробка потужних хімічних виробництв, нових, нетрадиційних джерел сировини зі зменшенням до нуля відходів виробництва.
Чи можливо це в принципі? Які шляхи розвитку хімічної науки та хімічної технології? І чи є вихід з цього майже безвихідного становища?
Підвищення потужності на мові хіміків означає збільшення швидкості хімічних реакцій. Зменшення відходів – це проведення хімічної реакції в потрібному напрямку без того, щоб одночасно утворювалися інші, непотрібні речовини. Ключ до вирішення цих проблем – каталіз. Потрібні нові каталізатори – речовини, що прискорюють протікання хімічного процесу в потрібному напрямку.
З каталізом людство знайоме давно. Явище прискорення хімічних реакцій за допомогою речовин, що спеціально вводяться – предмет вивчення хімічної науки і основа хімічної технології. Наріжний камінь нинішньої технології — гетерогенний каталіз – подарував людству масу нових хімічних процесів і нових речовин. Однак до теперішнього часу гетерогенний каталіз залишається надзвичайно недосконалим. Недосконалі наші знання про нього і, найголовніше, недосконалі самі каталізатори, що не забезпечують потрібних швидкостей реакцій і призводять, як правило, до утворення помітних кількостей побічних продуктів.
Створення каталізаторів – одне з головних завдань хімії. Хімічна технологія змінила кілька поколінь каталізаторів. Проте, залишається відчуття, що еволюція каталізаторів не встигає за бурхливим розвитком потреб суспільства. Чи є в цій галузі нові ідеї? Чи можна сподіватися створити досконалі каталізатори і на їх основі досконалі технологічні процеси?
На ці питання можна відповісти позитивно. Так, такі ідеї є і об’єднати їх можна загальною назвою — біогенізація технології.
Без каталізу немає життя
Спрямований перехід одних речовин в інші – одна з найбільш характерних рис живого. Питання про те, якими шляхами здійснюються такі переходи, вже давно займає уми вчених.
Для біохіміка життя при всій його складності, різноманітті, потаємності — лише послідовність декількох тисяч пов’язаних каталітичних реакцій. Для живого характерні в основному однотипні хімічні зміни, за допомогою яких переробляються поживні речовини. Швидкість цих змін і природа утворених речовин залежать від властивостей біокаталізаторів — ферментів, або ензимів.
Ферменти – одна з найбільш інтригуючих проблем сучасної науки. Біолог намагається зрозуміти механізм дії ферментів в живих клітинах; фізики досліджують будову біокаталізаторів; нарешті, хіміки вивчають ферменти для того, щоб зрозуміти, як вони проводять хімічні реакції.
Настільки пильна увага до проблеми, що виникла на стику різних галузей знання, призвела до того, що біокаталізатори в даний час вивчені краще, ніж звичайні хімічні каталізатори. Один з парадоксів сучасної науки в тому і полягає, що «молоді» проблеми, які захопили дослідників різних спеціальностей, розвиваються нині швидше і плідніше, ніж «класичні», що знаходяться під протекторатом однієї якої-небудь науки.
Жива клітина відрізняється від навколишньої її неживої природи тим, що в ній виробляються дуже великі і надзвичайно складні молекули. «Основна одиниця» життя являє собою високоорганізовану «фабрику молекул». Здатність синтезувати великі молекули з більш простих речовин – одна з головних відмінних рис живої клітини.
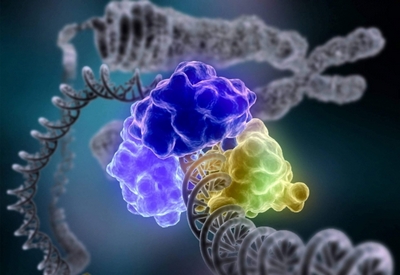
До числа таких макромолекул належать білки. Крім того, що білки складають основну частину «твердої» речовини клітини, багато з них володіють каталітичними властивостями, «працюють» прискорювачами хімічних реакцій, що протікають в клітині. Таким чином, за своєю природою ферменти – це білкові сполуки.
Послідовність амінокислот в них задана генетичним кодом. Величезна полімерна молекула ферменту «важить» в 103 — 105 разів більше, ніж молекула води. Але це ще не все. Щоб білок був ферментом, необхідно відповідне просторове розташування поліпептидного ланцюга.
Послідовність ланцюжка – всього лише первинна структура білка. В реальності йому важко уявити себе витягнутим в струнку. Під дією водневих зв’язків він тут же скручується в спіралі або петлі. Потім і ця вторинна структура під дією сил тяжіння або відштовхування різних груп ланцюжка ущільнюється в поліпептидний клубок. Спіралі і петлі химерно згинаються, «завмираючи» в третинній структурі. У ній то і зосереджена вся неповторність білка: саме в третинній структурі «віддрукувалися» його властивості.
Дослідження структури ензимів зрушилося з місця, коли був розвинений фізичний метод рентгеноструктурного аналізу. Майже тридцять років знадобилося Максу Перутцу, щоб дослідити гемоглобін — білок, здатний зв’язувати кисень. «Секрет життя здавався мені укладеним в структурі білка», – ділиться вчений з Кембриджа, удостоєний за своє фундаментальне дослідження Нобелівської премії. Так думали й інші дослідники. Зараз розшифровані структури багатьох ферментів. Побудовані просторові моделі їх третинних структур із зазначенням координат всіх атомів (а їх число, наприклад, в гемоглобіні, досягає десяти тисяч). Нарешті, вдалося синтезувати перший фермент – рибонуклеазу. Але хто з хіміків або фізиків може сказати, що він зрозумів, в чому основний секрет живого?
У вихорі високих швидкостей…
Дозволивши досліджувати багато ферментів, рентгеноструктурний аналіз все ж не відповів на головне питання: Як працює фермент, в чому причина його каталітичної активності? Справа в тому, що рентгеноструктурний метод дає уявлення про статичну, «нерухому» структуру біокаталізатора, в той час як фермент — динамічна, «працююча» система, світ високих швидкостей. В одну секунду він проводить реакцію, на яку знадобилося б в тих же хімічних умовах, але без каталізатора тисячі років! Одна молекула холінестерази з електричного ската «переробляє» за одну секунду триста тисяч молекул субстрату! Зазвичай ензими набагато «могутніше» і ефективніше простих каталізаторів.
Простий приклад: перекис водню — нестабільне з’єднання і вже в звичайних умовах перетворюється в воду і кисень. Цей процес прискорюється в присутності іонів заліза. У сто разів активніше цей же процес протікає, якщо іон заліза перевести в комплекс з досить складною органічною молекулою — протопорфірином. А якщо цей утворений комплекс, так званий гемін, помістити в активний центр ферменту каталази, то процес прискориться ще в десять трильйонів разів! Таким чином, перевага ферменту над простими каталізаторами обчислюється астрономічними цифрами.
Наші уявлення про механізм дії ферментів вельми просунулися вперед, коли вони стали вивчатися методами хімічної кінетики — науки, яка досліджує швидкості протікання хімічних процесів.
В основі дії ферментів лежать різні і досить ясні фактори. Найпростіший з них – концентраційний ефект. Щоб відбулася реакція, потрібна зустріч принаймні двох молекул. Чим менше в розчині молекул, тим менш імовірно їх зіткнення. В цьому випадку фермент може зіграти роль «свахи». Він «виловлює» з розчину молекули, зводить їх разом на своїй поверхні. «Познайомившись», різнойменні молекули реагують між собою. Таке концентрування молекулярних пар призводить до тисячократного прискорення реакції.
Однак не всяке зіткнення між молекулами загрожує реакцією. Важливо, щоб вони зістикувалися один з одним певними ділянками своїх поверхонь. Так ось, фермент не тільки концентрує молекули, різко підвищуючи шанси на взаємні зустрічі, але і орієнтує кожен раз реагуючі молекули певним чином одна щодо одної. «Орієнтаційний ефект» призводить до додаткового тисячократного прискорення реакції.
Всі реакції, що каталізуються ферментами, відбуваються на невеликій ділянці молекули ферменту, складеної з строго підібраних хімічних груп. Це і є «активний центр ферменту» – «театр», в якому розігруються блискавичні трагедії, супроводжувані розривом старих і утворенням нових хімічних зв’язків. Групи біокаталізатора притягують молекули з розчину, орієнтують їх відповідним чином і «атакують» їх. Як правило, число цих «бойових» груп ферменту, що безпосередньо проводять реакцію, невелика: близько десятка амінокислотних залишків, з яких вибудувана молекула біокаталізатора.
У первинній структурі ферменту вони розсіяні по всій довжині поліпептидного ланцюга. Але при побудові третинної структури вони стягуються в один район молекули, утворюючи активний центр. Ось чому настільки важлива просторова організація ферменту: основні властивості його укладені в третинній структурі. Варто їй «засмутитися», як тут же зникнуть унікальні каталітичні здібності білка. Білки, що не володіють третинною структурою, не мають активного центру.
За тисячну частку секунди активний центр здатний приєднати молекулу перетворюваного з’єднання (субстрату), провести в ній необхідні хімічні зміни і викинути в середовище продукти реакції. Причому атаку на субстрат він веде одночасно декількома групами. Узгоджена взаємодія їх, до всього іншого, теж багаторазово прискорює реакції. Таким чином, у ферменту не один, а кілька потужних механізмів активації.
Присутність ферменту дозволяє замінити порівняно повільно протікаючий прямий процес декількома більш швидкими реакціями. Біокаталізатор змінює конкретний шлях реакції – з’єднуючись з перетвореною речовиною, він утворює нові реакційноздатні проміжні сполуки, що швидко переходять одна в одну. У процесі перетворення вихідної речовини в продукти реакції в активному центрі утворюються надзвичайно активні, нестійкі проміжні сполуки ферменту і субстрату, що живуть тисячні частки секунди. Однак їх вдається зареєструвати, ідентифікувати і вивчити завдяки розробленим методам дослідження «швидких» реакцій. Сучасні кінетичні способи дозволяють реєструвати процеси, що протікають в активних центрах ензимів протягом однієї мільйонної частки секунди.
Дослідження структури ферментів і вивчення швидкостей реакцій, що каталізуються ними доповнюють один одного, багато додають в наше знання про природу чудо-прискорювачів.
«Верстат з програмним управлінням»
Фермент володіє багатьма властивостями, які зазвичай не зустрічаються у каталізаторів інших типів. Звичайні каталізатори, наприклад, чутливі тільки до типу процесу, але мало звертають уваги на вигляд молекули, що перетворюється. Каталізатори дегідратації спиртів утворюють відповідні продукти з будь-яких спиртів, здатних досягти поверхні каталізатора.
Ферменти набагато розбірливіше. Зазвичай вони проводять каталітичні перетворення тільки небагатьох молекул одного класу, володіючи, таким чином, субстратною специфічністю. Причому величезна кількість ферментів здатна здійснювати перетворення лише одного субстрату, проявляючи інертність до інших, дуже схожих за структурою молекулам.
Питання про те, чому ферменти такі розбірливі – одна з основних проблем сучасної теорії ферментативного каталізу. Вперше це питання поставив собі американський хімік Еміль Фішер. Як відповідь він сформулював вельми загальне уявлення, яке отримало назву концепції «ключа і замка». Активний центр ферменту володіє заданими геометричними властивостями і таким розподілом полярних і неполярних груп, які дозволяють пропустити до нього тільки молекули зі строго визначеними властивостями. При цьому контролюється не тільки хімічний склад реагентів, але і їх просторова будова. Ще на початку минулого століття Еміль Фішер першим сформулював якісне уявлення про природу специфічності: субстрат підходить до ферменту, як ключ до замку.
У п’ятдесяті роки минулого століття англійський вчений Кошланд звернув увагу на те, що ферменти здатні зазнавати деякі структурні зміни в залежності від зовнішніх умов і в присутності певних молекул. Це дозволило йому постулювати гіпотезу індукованої відповідності. Згідно з цією гіпотезою, «хороший», специфічний субстрат, взаємодіючи з ферментом, сам змінює просторове розташування хімічних груп, що утворюють його активний центр. «Поганий» ж, неспецифічний субстрат таких інформаційних змін викликати не в змозі, активний центр «дрімає», реакція не протікає.
Гіпотеза Кошланда знайшла широке визнання, і в ряді робіт було експериментально показано, що каталітична дія ферментів дійсно пов’язана зі структурними змінами білкової молекули. Однак до теперішнього часу залишається відкритим питання, чи визначають ці зміни високу специфічність ферментів. Проста відповідь про природу субстратної специфічності ферментів була запропонована І. В. Березіним і доктором хімічних наук К. Мартінеком. Питання можна переформулювати так: чому ферменти прискорюють перетворення одних субстратів більшою мірою, ніж інших? Сутність уявлень, розвинених І. В. Березіним і К. Мартінеком, полягає в наступному.
Ферменти, як говорилося, перетворюючи субстрати в продукти реакції, утворюють проміжні сполуки – недовговічні комплекси субстрату з групами, складовими активний центр ферменту. Це так званий «комплекс Міхаеліса», вперше, виявлений на початку минулого століття. Як правило, утворення «комплексу Міхаеліса» протікає дуже швидко майже при кожному зіткненні субстрату з активним центром ферменту. Деякі ферменти мають активний центр, що складається як би з двох ділянок, що розрізняються за функціями. Одна ділянка, адсорбційна, приєднує субстрат до ферменту і утворює «комплекс Міхаеліса», концентрує і орієнтує молекули перетворюваної речовини щодо другої каталітичної ділянки, де в бойовій готовності завмерли групи, атакуючі певні зв’язки молекули субстрату.
І ось, грунтуючись на «класичній» для хімічної кінетики теорії перехідного стану, хіміки виявили, що ферменти можуть використовувати вільну енергію, яка утворюється, коли виникає зв’язок субстрату з сорбційною ділянкою активного центру — для кращої «роботи» іншої, каталітичної стадії процесу. Чим міцніше зв’язок молекули субстрату з сорбційним центром, тим швидше протікає реакція перетворення субстрату в продукт. Але споживати цю енергію за призначенням може тільки «хороший» субстрат.
Така двоцентрова модель була підтверджена кількісним експериментом для А-хімотрипсину, ферменту підшлункової залози, який відіграє певну роль у розщепленні білків їжі.
Можна детально уявити собі «драму» подій, що розвиваються. Активний центр ловить молекули перетворюваної речовини за їх неполярні групи, екстратируючи їх з водного розчину. Останні охоче прагнуть вискочити з полярної води і приліпитися до «рідної» неполярної краплі. Сила, що змушує їх йти з води і «злипатися», носить назву гідрофобної взаємодії.
Молекула субстрату орієнтується на активному центрі гідрофобними, водневими, донорно-акцепторними зв’язками. Тут і вступає в силу вибірковість ферменту: будь-яка неполярна молекула може сісти на краплю, але тільки деякі будуть потім піддані бомбардуванню його атакуючими групами. Справа в тому, що для цього реагуючі зв’язки повинні знаходитися в строго певному місці молекули ферменту.
Таким чином, неповторна своєрідність ферментів-біокаталізаторів полягає в структурі їх складно організованих активних центрах. При всьому різноманітті будови глобул білка будова активного центру дивно одноманітна: «щілина» для «заковтування» субстрату і кілька строго орієнтованих в просторі і один до одного каталітично активних груп. Речовина, потрапляючи в поле дії цих хімічних груп, зазнає серію послідовних змін за суворою програмою.
Багатовіковий відбір і еволюція ферментів відшліфували цю програму таким чином, що процес переходу молекули в продукт реакції протікає по найбільш вигідному шляху, не пов’язаному з подоланням високих енергетичних бар’єрів або попаданням в глибокі енергетичні ями. Ось чому фермент – це, за висловом академіка М. М. Семенова, верстат з програмним управлінням, налаштований на виготовлення однієї деталі. Без такої специфічності ферментів існування життя виявилося б неможливим.
Перші ластівки біотехнології
Сьогодні ми є свідками явного стрибка в розумінні ферментативного каталізу. Він не пов’язаний з яким-небудь фундаментальним відкриттям останніх років, а підготовлений поступовим накопиченням окремих фактів, які зробили більш-менш ясною всю картину в цілому. Ці факти відносяться до встановлення складу активних центрів, їх третинної структури, до виявлення «елементарних» стадій ферментативних реакцій. Виникає відчуття, що явище зрозуміле. Але це не зовсім вірне відчуття.
Хоч нам і відомі основні фізико-хімічні закономірності ферментативного каталізу і хоча ми можемо якісно описати основні ефекти збільшення швидкостей, але в цілому явище це ми розуміємо лише на рівні наших сучасних уявлень про природу взаємодії між молекулами. І тому наші знання про ферменти в значній мірі поверхневі. Існує широке коло питань, які не вирішені. Чому ферменти «працюють», утворюючи проміжні сполуки? Найчастіше число цих з’єднань, «живуть» тисячні частки секунди, близько десятка. Яким чином задається програма, що забезпечує послідовність взаємодій груп ферменту з субстратом? Таких питань ще багато, але серед них є одне — принципове для хімії: що потрібно робити, щоб отримати каталізатори, які не поступаються за ефективністю ферментам?
Розмова про біотехнологію – тема особлива, і у цій статті висвітлити її навряд чи можливо. На наших очах виникає ціла галузь зі своєю програмою, що має вже ряд успіхів. У цій статті будуть наведені лише приклади з цієї області.
Намітилися дві стратегії експлуатації хіміками науки про ферменти. По-перше, моделі. Багато хіміків використовують сучасні уявлення про природу ферментативного каталізу з метою створити аналоги ферментів. Скажімо, проблема «фіксації» молекулярної азоту, яка давно приваблювала хіміків, вирішується, загалом, моделюванням деяких рис ферментативного каталізу.
По-друге, ферменти як ефективні каталізатори можуть безпосередньо використовуватися для вирішення деякі важливих завдань. Отримують їх зазвичай за допомогою мікроорганізмів, використовуючи швидкісний механізм біосинтезу білків, відпрацьований еволюцією. Розвинулася техніка культивування мікроорганізмів. Тому дослідники, зайняті ферментативним каталізом, не терплять потреби в об’єкті своєї діяльності.
Крім того, при нинішній біохімічній методиці можна мати в розпорядженні практично чисті препарати ферментів. Таким чином, ферменти стають поширеними та доступними каталізаторами. Важливо і те, що навчилися робити ферменти не настільки чуйними до змін середовища — стабільними і «консервувати» їх, «пришиваючи» до твердих речовин-«ферментоносіїв».
В цілому наука про ферменти являє собою цікаве і навіть повчальне явище. З одного боку, ми бачили, як навпомацки, невпевнено, поки ще розкривається «внутрішнє життя» біокаталізаторів, механізм їх роботи. З іншого боку, хімічна ензимологія, гілка цієї галузі знання, підійшла зараз до того рубежу, за яким і лежить рішення захоплюючої проблеми — використовувати високі переваги біокаталізаторів у виробничих цілях, з метою створення принципово нової, біогенної технології.
Ферментна інженерія знаходиться в стадії становлення. У неї безліч своїх власних завдань практичного характеру, пов’язаних з синтезом надійних ферментів, подовженням термінів експлуатації «живих» каталізаторів. Проте непорушним залишається те, що застосування ферментів обіцяє те саме зрушення в технології, в якому так потребує промисловість.
Фермент годує. Фермент лікує. Економить паливо і дорогоцінні метали у виснаженій коморі природи. Перетворює звичайну воду в першокласне пальне, громіздкі великотоннажні хімічні виробництва — в невеликі підприємства, що нагадують лабораторії. Можливості ферментної інженерії прояснені далеко не повністю. Вона ще молода, але вже подарувала людству чимало надій.
Автори: С.Варфоломєєв, І. Магай.

