Океан під мікроскопом

Гідродинаміки звикли мати справу з «ідеальною рідиною». І нерідко при побудові гідродинамічних моделей океану зовсім забувають про те, що океан заповнений водою — рідиною аж ніяк не ідеальною. До того ж океан — це і не тільки вода, це розчинені солі, зважені мінеральні частинки, колоїди, гази, органічна речовина. Причому всі компоненти знаходяться в складній взаємодії.
Ми, океанологи, не можемо вивчати цю багатокомпонентну систему в цілому – вона занадто складна. Біда в іншому – нерідко ми немов забуваємо, що вона взагалі існує. У деяких випадках ми продовжуємо закривати очі на давно відомі факти. Однак у зв’язку з розгорнутими в останні роки дослідженнями робити це все важче. А чому – читачеві має стати ясно після прочитання статті.
Звичайна вода
Хіміки жартують: немає в природі речовини більш брудної, ніж чиста вода. Що може бути простіше? Н20 – два атоми водню з’єднані з атомом кисню. Хімічна речовина, яка покриває більше сімдесяти відсотків поверхні земної кулі… Хімічна речовина, яка тече з кранів водопроводу в нашій квартирі… Важко повірити в її незвичайність! Звичайна вода?
Зі шкільної лави ми знаємо, що властивості всіх хімічних елементів і їх сполук визначаються положенням елементів в періодичній системі Д. І. Менделєєва. Ви пам’ятаєте, в 1870 році великий вчений, демонструючи могутність створеної ним системи, вперше в історії хімії передбачив існування ще не відомих науці елементів: екабора, екаалюмінію і екасіліцію. Мало того, він передбачив властивості цих елементів і їх сполук.
Звичайно, ніхто в наші дні не сумнівається в справедливості періодичного закону. Його сучасне формулювання записане золотими літерами на скрижалях науки: «властивості хімічних елементів в утворених ними простих і складних з’єднаннях знаходяться в періодичній залежності від величини заряду їх атомних ядер».

Спробуємо, керуючись періодичним законом, визначити елементарні властивості води – гідриду кисню. На таблиці Менделєєва кисень стоїть у Via групі. Аналоги кисню: сірка, селен, телур. Аналоги води (Н20) — гідриди: H2S, H2Se, Н2Те. Властивості цих гідридів, дійсно, закономірно змінюються. І виходячи з них, ми знаходимо, що, наприклад, температура плавлення четвертого гідриду – води – близько мінус 100 градусів. Але ми-то знаємо, що лід плавиться при 0 градусів! Точно так само ми знайдемо, що вода повинна кипіти при температурі мінус 80 градусів. Різниця ще більш вражаюча – вода кипить при плюс 100 градусів!
Не треба, звичайно, ставити під сумнів закон. Просто вода – рідкісне виключення з правил. Фактично всі її властивості навіть не просто аномальні, а унікальні.
- Теплоємність води – найбільш висока серед всіх твердих і рідких речовин, за винятком рідкого аміаку і водню.
- Прихована теплота плавлення – найбільш висока з усіх речовин, за винятком тих же рідкого аміаку і водню.
- Прихована теплота випаровування – найбільш висока з усіх речовин (вже без всяких винятків).
- Поверхневий натяг – найбільш високий з усіх рідин.
- Теплопровідність – найбільш висока з усіх рідин…
Цей список можна і продовжити, але ви, напевно, вже розумієте, що жарт хіміків має дуже серйозні підстави. Немає речовини більш незвичайної, більш дивної і загадкової, ніж звичайна вода!
Чому вона тече!
На жаль, жарт забарвлений сумом – пояснити причини аномальності води не вдається. У всякому разі, пояснити до кінця. Багато чого, звичайно, зрозуміло. Перша причина – будова самої молекули.
Можна було б думати, що молекула лінійна, тобто має вигляд:
Н-О-Н
Але в дійсності зв’язки О-Н утворюють між собою деякий кут, і молекула має вигляд:
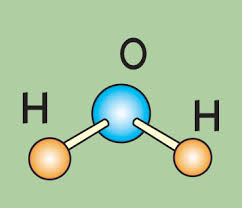
Атоми водню несуть на собі деякий позитивний заряд, а атом кисню — негативний. Тому кожна молекула являє собою диполь – крихітний магнітик: +—
Уточнюючи цю картину, молекулу води можна уявити собі у вигляді неправильного управління гвинта. На осі його «насаджено» ядро атома кисню, дві сусідні лопаті закінчуються позитивно зарядженими атомами водню, а дві інші — двома парами негативно заряджених електронів.
Різнойменно заряджені лопаті сусідніх молекул охоче притягуються один до одного, так що в принципі кожна з молекул може бути пов’язана з чотирма іншими. Саме ці зв’язки визначають внутрішню міжмолекулярну структуру – другу і головну причину аномальних властивостей води.
Вчені знають структурні формули сотень тисяч хімічних речовин, навіть таких складних, як ДНК, яка відповідальна за спадковість. Але міжмолекулярна структура «звичайної» води як і раніше не піддається розшифровці. Воістину «вражаюча сила людського розуму, але ще більш вражаюча складність питань, які ставить перед людиною природа»! Запропоновано вже десятки гіпотез, що пояснюють аномальність води. Серед їх авторів чимало найбільших вчених: Бернал, Полінг, Попл… Гіпотези, як зауважив американський хімік Р. Хорн, «продовжують з’являтися із загрозливою швидкістю», що саме по собі свідчить про їх недосконалість.
Як не дивно, але зовсім не просто пояснити таку буденну властивість води, як… плинність. Взагалі всі труднощі пов’язані саме з рідкою водою.
Водяна пара – це добре відомо – складається з окремих (мономерних) молекул з невеликою домішкою димерів і ще меншою — тримерів.
Навпаки, лід має дуже жорстку структуру. Кожен атом кисню пов’язаний водневими зв’язками з чотирма (пам’ятайте — чотирилопатевий гвинт) іншими атомами кисню, які розташовуються у вершинах тетраедра.

Вишукана витонченість сніжинок і морозних візерунків на вікнах — наслідок правильної кристалічної структури льоду. Лід – кристал, ні про яку плинність тут не може бути й мови. Однак є серйозні підстави припускати, що і в рідкій воді зберігається жорстка льодоподібна структура.
Забігаючи вперед, доведеться сказати, що для випаровування грама води необхідно затратити близько 540 калорій, а для плавлення грама льоду — тільки близько 80. У першому випадку (при випаровуванні) повинні бути розірвані всі міжмолекулярні зв’язки (водяна пара, як ви пам’ятаєте, мономірна). Зіставлення чисел 540 і 80 наводить на думку, що при плавленні льоду принаймні п’ять з шести водневих зв’язків залишаються нерозірваними. А значить, і в рідкій воді зберігається льодоподібна структура.
Виходячи з цього, вчений О. Я. Самойлов ще близько тридцяти років тому запропонував одну з найбільш досконалих теорій міжмолекулярної структури води. Самойлов підкреслює, що ажурна решітка льоду містить всередині свого каркаса досить великі порожнини (відстань між атомами кисню більше, ніж «розмір» одиночної молекули). При плавленні льоду частина решітки руйнується, а окремі вільні молекули можуть потрапляти всередину каркаса.
Всі ми звикли бачити плаваючий лід і вважаємо, що це, начебто, само собою зрозуміло. Насправді ж ми стикаємося тут з ще однією аномалією води. Щільність всіх твердих речовин при плавленні зменшується, і тому вони завжди важче своєї рідкої фази, завжди тонуть у власному розплаві.
Лід легший за воду, і це знаходить цілком логічне пояснення в теорії Самойлова. Дійсно, щільність повинна збільшуватися, якщо вільні молекули заповнюють порожнечі в льодоподібному каркасі. Адже упаковка стає більш щільною. Можна пояснити й інші аномалії, але деякі здивовані питання все ж залишаються.
Ще більше трьохсот років тому саме температура замерзання води була прийнята за відлікову точку — нуль градусів. Вважалося, що вона завжди постійна. Однак вода, як з’ясовується, дуже «не любить» замерзати. Воду легко переохолодити, якщо попередньо видалити з неї розчинені гази (наприклад, ретельно прокип’ятити). У лабораторних дослідах, навіть охолодивши воду до мінус сімдесяти градусів, вдається уникнути появи льоду. Але варто опустити в посудину кристалик льоду, як тут же поверхня води миттєво замерзне, а температура самої води «підскочить» до нуля градусів.
– Необхідна присутність центрів кристалізації, – кажуть вчені, – це може бути і кристалик льоду, і піщинка, і крихітний пухирець повітря.

Але чому ж центром кристалізації не може бути сама льодоподібна структура, якщо вона зберігається в рідкій воді? І, по-друге, якщо жорстка льдоподібна структура майже цілком зберігається, то як пояснити плинність рідкої води?
Залишимо, втім, осторонь теоретичні дискусії – вода аномальна, хоча ми і не розуміємо до кінця причини цього. Важливо, що саме незвичайність води робить наш світ таким, як він є.
Світ без води!
Його важко, мабуть, навіть неможливо уявити при найпалкішій уяві. Поставимо перед собою більш скромне завдання – поговоримо докладніше про значення окремих аномалій води. Якщо не дуже піклуватися про точність формулювань, то теплоємність можна визначити як здатність речовини поглинати або віддавати тепло, не змінюючи своєї температури, як здатність протистояти нагріванню або охолодженню.
Для нагрівання грама води потрібно витратити в два рази більше тепла, ніж для нагрівання грама будь-якої іншої речовини, і майже в десять разів більше, ніж для нагрівання грама піску, грунту або скельної породи. Завдяки цьому океан на відміну від суші «неохоче» нагрівається і «неохоче» віддає тепло. Важливість цієї обставини важко переоцінити.
Перепад температур на безводному Місяці – близько двохсот п’ятдесяти градусів. У земному океані — від екватора і до Північного полюса – близько тридцяти. Завдяки великій теплоємності води океан Землі працює, як гігантський термостат, згладжуючи коливання температури.
Звичайно, не тільки близькість до океану має значення. Порт Архангельська надовго замерзає, а порт Мурманська, який розташований на півтисячі кілометрів північніше, працює цілий рік завдяки теплій Північно-Атлантичній течії, що зароджується в Мексиканській затоці.

Зверніть увагу, через високу теплоємність води течії дуже довго зберігають свою «індивідуальність». Весь Північний Льодовитий океан, наприклад, на глибинах від двохсот до тисячі метрів заповнений водами Атлантики, які роками залишаються теплими, хоча над ними і під ними температури негативні. Теплоємність води, а точніше різниця в теплоємності океану і суші, пояснює виникнення бризових і мусонних вітрів.
Не менш важлива особливість води – унікально висока прихована теплота пароутворення. Для випаровування грама води потрібно затратити в три рази більше тепла, ніж для випаровування спирту, і у вісім разів більше, ніж для випаровування ртуті.
Випарувати воду дуже важко – на це витрачається велика частина сонячної енергії, що приходить на Землю. В цілому по земній кулі в атмосферу «підноситься» мільярд або більше тонн водяної пари. Ні, не за добу – тільки за одну хвилину!
При конденсації водяної пари у верхніх шарах повітря все тепло, яке було витрачено на випаровування, знову виділяється — щохвилини 2×1018 джоулів. Щоб виробити таку кількість енергії за одну хвилину, треба було б сорок мільйонів електростанцій потужністю по мільйону кіловат кожна.
Сама атмосфера майже прозора для сонячної радіації. Вона затримує не більше четвертої частини вхідного випромінювання. Обігріває атмосферу саме тепло, що виділяється при конденсації водяної пари. Це та енергія, яка живить загальну циркуляцію атмосфери, яка породжує вітри і шторми, смерчі і тайфуни.

Тайфун середньої сили несе в собі енергію, еквівалентну тридцяти-п’ятдесяти тисячам атомних бомб. Звичайно, ми не можемо (і чи зможемо?) боротися з тайфуном, коли він, зародившись в тропічних широтах, починає рухатися, змітаючи все на своєму шляху. Але енергія, яку накопичив тайфун, це енергія водяної пари, що випарувалася. Мабуть, коли-небудь ми зможемо попереджати зародження грізних вихорів, штучно зменшуючи випаровування – в потрібний момент і в потрібній точці океану. Подібні експерименти вже починають проводитися…
Для нас, жителів помірних широт, дуже важливе значення має і аномально висока прихована теплота плавлення. Фазові переходи води, перебудова її міжмолекулярної структури болісні. Через них зима відокремлена від літа навесні і восени. Дійсно, лід і сніг можна досить швидко прогріти до температури танення. Але щоб розтопити лід і сніг, потрібно затратити у вісім разів більше сонячного тепла і часу — танення поглинає силу-силенну енергії.
Чимале значення має і та обставина, що незабруднені, невинно білі поверхні відображають більшу частину радіації. Але все-таки в першу чергу саме завдяки високій теплоті плавлення льоду існує весна.
При утворенні ж льоду, тепло, навпаки, виділяється – ми нерідко забуваємо про це. І зима не відразу вступає в свої права. Ще в 1929 році американський професор X. Шелдон запропонував використовувати це «забуте» тепло.
«При замерзанні кубічного метра льоду, – писав Шелдон,— виділяється стільки ж тепла, скільки дає спалювання двадцяти двох фунтів вугілля. Річка Святого Лаврентія виносить в море щодня більше енергії, ніж може бути вироблено при спалюванні всього вугілля, що видобувається в Канаді протягом року».
Залишимо осторонь технічну сторону питання – я не беруся оцінювати можливості практичної реалізації проекту. Але, може бути, про нього варто згадати енергетикам? Поговоримо про силу, яка здається дещо нереальною – про силу поверхневого натягу.
Молекула, що знаходиться всередині рідини, відчуває тяжіння сусідніх молекул у всіх напрямках. Якщо ж молекула розташована на самій поверхні, то міжмолекулярні зв’язки можуть виникати тільки в нижній півсфері. Молекула як би втягується всередину рідини.
Поверхневий натяг води більше, ніж будь-якої іншої рідини. Вельми істотно, що внесення навіть мінімальної кількості забруднюючої речовини, як правило, в кілька разів зменшує поверхневий натяг води.
Завдяки цій властивості на поверхні води навіть при легкому вітрі утворюються капілярні хвилі. Найчастіше, втім, їх називають «брижами» — висота капілярних хвиль не перевищує десятих часток сантиметра. Брижі як би збирають «в гармошку» поверхню моря, збільшуючи тим самим його площу приблизно в півтора рази. А отже, в півтора рази збільшується і випаровування (яке пропорційно цій площі), і надходження тепла в атмосферу. До речі сказати, брижі і громади штормових хвиль ділять енергію вітру приблизно навпіл — несподіванка, чи не так.
Капілярні явища також дуже тісно пов’язані з поверхневим натягом. Змочуючи стінки тонкої капілярної трубки, вода утворює увігнуту поверхню (увігнутий меніск). Поверхневий натяг постійно прагне випрямити цю увігнутість, і стовпчик рідини повзе вгору всупереч силі тяжіння. Те ж саме відбувається і в природних капілярах — в порах грунту і в самих рослинах. Завдяки цьому грунтові води можуть підніматися на 10-12 метрів вище природного рівня, підносячи вологу до поверхні і живлячи рослини. Землеробство було б неможливо без капілярних явищ.

Розчин всіх солей
Вода – найсильніший на Землі розчинник. Можливо, ця обставина виявилася вирішальною в складному процесі зародження життя на нашій планеті.
Діелектрична постійна чистої води – найбільш висока з усіх рідин. Її величина дорівнює вісімдесяти – це означає, що два різнойменних заряди притягуються у воді один до одного з силою у вісімдесят разів меншою, ніж в повітрі.
Міцність речовини визначається міжмолекулярними зв’язками – взаємодією позитивних зарядів атомних ядер і негативних зарядів електронів. Але кожна молекула води сама диполь. Тому в речовині, зануреній у воду, міжмолекулярні зв’язки послаблюються у вісімдесят разів. Речовина розчиняється, або розпадаючись на окремі молекули, як цукор, або — на заряджені іони, як кухонна сіль.
Будь-який елемент таблиці Менделєєва в тій чи іншій кількості можна виявити у водах Світового океану. А сумарна загальна солоність в середньому дорівнює трьом з половиною відсоткам, або, як кажуть океанологи, тридцяти п’яти проміле.
Розчинені речовини самі впливають на внутрішню структуру води, на її властивості, причому різні речовини по-різному.
У першому наближенні морська вода – просто-напросто 0.5 М – розчин кухонної солі. Можна приготувати кілограм морської води, розчинивши 29,22 грама NaCl в 970,78 грама дистильованої води. Проведемо дослід в мензурці, помітивши попередньо обсяг води і обчисливши обсяг солі. Ми відразу ж виявимо, принаймні, три чудових явища. По-перше, температура води знизиться – на розчинення солі, на розрив зв’язків, буде витрачено близько шестисот калорій. По-друге, електропровідність різко — більш ніж в десять тисяч разів – зростає. І по-третє, ми з подивом переконаємося, що вода спростовує і правила складання. Сумарний обсяг розчину буде на п’ять мілілітрів менше, ніж сума обсягів води і солі. Розчин як би стиснувся.
Різке зростання електропровідності пояснюється, очевидно, розкладанням солі на окремі іони натрію і хлору, які і переносять електричні заряди.
Складніше йде справа зі зменшенням обсягу – воно пояснюється явищем, яке називається електрострикцією. Кулонівські поля іонів притягують до себе молекули води і тим самим змінюють її внутрішню структуру. Кожен іон в розчині як би «обліплений» молекулами води — гідратований.
Почасти саме з електрострикцією пов’язано явище, яке в океанології називається ущільненням при змішуванні. Водні маси, навіть мають однакову щільність, але різні температури і солоності, змішуючись, стають більш щільними і занурюються, формуючи глибинні води.
До сих пір ми говорили про штучну морську воду — про розчин кухонної солі. Однак в реальному океані розчинено безліч солей, причому не всі іони, подібно іонам натрію і хлору, ущільнюють, впорядковують структуру. Якщо розміри іонів перевищують розміри пустот в льдоподібному каркасі води, то, прагнучи «втиснутися» в порожнечу, іони руйнують каркас. Якщо до того ж заряд такого іона невеликий, то розірвані водневі зв’язки не можуть бути заміщені взаємодією іона з відірваними молекулами. Вони набувають велику рухливість, і в цілому структура води стає більш пухкою. До невпорядкованих іонів відносяться, наприклад, іони калію, рубідію, цезію, брому, йоду.
Ущільнення структури води при електрострикції можна уподібнити дії тиску. Вода, хоч і в незначній мірі, але стискається. Зменшення обсягу на п’ять мілілітрів як це спостерігалося в нашому досліді, може бути досягнуто, якщо прикласти тиск близько ста атмосфер. На глибині тисяча метрів якраз такий тиск. Невпорядковані іони, руйнуючи структуру, як би зменшують тиск, створюють розрідження.
Вчених завжди дивувало, що кашалоти вільно пірнають на глибину тисяча метрів і більше, не відчуваючи звичайних при зануренні труднощів. Нещодавно було висловлено припущення, що на поверхні тіла кашалота виділяється якась речовина, яка руйнує міжмолекулярну структуру води і послаблює зовнішній тиск. Фантастика? Напевно, так, але, може бути, і ні. Тварини вміють використовувати особливості середовища, де вони мешкають, найдивовижнішим чином.

Розчинені солі, змінюючи структуру води, змінюють, природно, і її властивості. Дуже своєрідний, наприклад, процес замерзання в океані. Аж до початку минулого століття вчені всерйоз думали, що морська вода взагалі не замерзає, що льоди Арктики, наприклад, приносяться в океан сибірськими річками. Деякі розумні підстави для подібної омани, звичайно, були: китобої, а потім і полярні мандрівники не раз могли переконатися, що лід, плаваючий в океані,— прісний або майже прісний. А якщо так, то його річкове походження не викликало сумнівів.
Ми знаємо тепер, що морська вода починає замерзати при більш низькій температурі, ніж прісна,— мінус 1,9 градуса. Взагалі, чим вище солоність, тим нижче температура замерзання. Молодий, щойно утворений лід не зовсім прісний. Він містить всередині себе капсули розсолу, що і робить його солонуватим. Але поступово цей розсіл стікає, і лід дійсно стає прісним.
А солоність самої морської води при льодоутворенні підвищується, отже, знижується її температура замерзання. І якщо ми поставимо лабораторний дослід, то побачимо, що товщина льоду буде поступово зростати, а солоність рідкої фази збільшуватися. Остаточно вода в пробірці замерзне тільки при температурі нижче мінус 30 градусів!
Тут виникає ще одне цікаве питання. Для «звичайних» хімічних речовин справедливо твердження: чим нижче температура, тим більше щільність речовини. Прісна вода, однак, має найбільшу щільність не в точці замерзання, а при температурі плюс 4 градуси.
– Завдяки цьому, – вчили нас у школі, – біля дна озер температура завжди позитивна, завдяки цьому водойми не промерзають щорічно до дна.
Все вірно, але як бути з морською водою? Вона-то поводиться як «звичайна» речовина. І, скажімо, в Антарктиці навіть кілометровий шар води може бути охолоджений до температури замерзання. Але лід все-таки не утворюється – чому? Виявляється, збільшення тиску теж впливає на структуру води і, зокрема, знижує температуру замерзання. Для морської води цей процес фактично не вивчений. А ось прісна вода при підвищенні тиску до 2000 атмосфер замерзає вже при температурі мінус 22 градуси. При більш високих тисках картина стає все більш дивовижною – сам лід знаходить інші властивості. Спочатку він стає важче води і опускається на дно. Потім знову спливає, а температура його плавлення починає підвищуватися — до плюс 80 градусів. Існує навіть «розпечена» модифікація льоду, який плавиться тільки при температурі 175 градусів!
І океан складається з молекул
Колись, на зорі нашої науки, за допомогою ареометрів визначали реальну щільність морської води. Тепер ми визначаємо деяку фіктивну щільність, розраховуючи її по солоності і температурі. Це вірно, точність значно підвищилася – до п’ятого знака після коми. Ми начебто переконані – щільність води в даній точці і на даній глибині 1,02795. Насправді це якась фікція. Крім температури і солоності щільність залежить ще й від каламутності, від кількості зважених частинок, мікроорганізмів і т.д., відомо, наприклад, що щільність води жовтої річки Хуанхе може досягати 1,1 г/см3. У мутних потоках – вони поширюються біля дна океану – щільність нерідко перевищує 1,2 г/см3.

Чи потрібен нам п’ятий знак, якщо ми не вимірюємо одночасно каламутність води, якщо ми за рахунок цього можемо помилятися в четвертому, третьому або навіть другому знаку?
Щільність – найважливіша характеристика води. За щільністю ми розраховуємо течії, глибину циркуляцію вод. Чи правильно ми уявляємо її собі, не знаючи істинної щільності? Але ж ми ще не враховуємо, що зважені частинки теж впливають на структуру води, а отже, і на її властивості.
Цікаві ефекти пов’язані з виділенням так званої теплоти змочування. Хіба не дивно – воду можна нагріти, буквально посипаючи її попелом. Молекули води, вступаючи в контакт з адсорбуючою поверхнею, втрачають свою рухливість, зв’язуються, виділяючи внутрішню кінетичну енергію у вигляді теплоти змочування. Її кількість залежить від розмірів зв’язуючих частинок і їх мінерального складу. У найпершому наближенні можна стверджувати, що при випаданні грама тонко-розмолотих частинок на поверхню води виділяється до восьмисот і більше калорій.
Чи може виділення теплоти змочування як-небудь впливати на тепловий режим водойми або Світового океану в цілому? Відповісти на це питання важко, але деякі оцінки можливі.
На думку вчених, в даний час наземні вулкани щорічно викидають при виверженнях приблизно півтора кубічних кілометра вулканічного матеріалу. Це, звичайно, зовсім небагато. Найбільш приблизні оцінки показують, що глобальна теплота змочування в мільйон або навіть в десять, сто мільйонів разів менше, ніж щорічне надходження сонячного тепла.
Ну, а далі кожному вільно будувати будь-які гіпотези. Звичайно, вулканічна діяльність була в минулому значно активніше, Земля могла потрапити в хмару космічного пилу і т.д. у всякому разі, в геологічній історії Землі відзначено кілька випадків різкого оновлення водної фауни, які, мабуть, збігаються з періодами інтенсивного вулканізму.

До недавнього часу здавалося, що, вивчаючи реальний океан, взагалі можна знехтувати процесами, що відбуваються на молекулярному рівні. Здавалося, що океан турбулізований від поверхні до дна. Який сенс говорити про молекулярну передачу тепла, якщо турбулентна теплопровідність в тисячі разів більше? Однак тепер загальноприйнята точка зору змінюється.
Мабуть, в результаті молекулярних процесів може виникати конвекція, що різко підсилює перенесення тепла.
Виявляються такі тонкі і незвичайні її механізми, як, наприклад, подвійна дифузія. Океан можна порівняти з листковим пирогом — окремі шари відрізняються один від одного по температурі і солоності. З плином часу перепад характеристик зменшується. При цьому важливо, що температура вирівнюється за рахунок молекулярних процесів приблизно в сто разів швидше, ніж солоність.
Подальші міркування необхідно ілюструвати схемою. Спочатку (а) нижній шар має більш високу щільність. Здавалося б, конвекції ніяк не виникнути, обмін буде цілком відбуватися за рахунок молекулярних процесів. Але через деякий час (б) температура вже встигне вирівнятися, а солоність ще ні. Нижній шар поки ще менше солений, але тепер вже і щільність його стала нижчою. Виникла нестійкість. Якщо різниця щільності досить велика, то в момент (б) обмін може різко посилитися — виникне своєрідна форма конвекції, яку океанологи називають «сольовими пальцями».
За останні роки в усьому світі різко посилився інтерес до вивчення фізико-хімічних властивостей води – як морської, так і прісної. При цьому виявляються нові і вельми несподівані ефекти.
Показано, наприклад, що урожай огірків і редиски можна збільшити більш ніж в два рази, якщо перед посівом замочити насіння на півтори години в талій воді. Урожай пшениці при подібній обробці насіння збільшується в півтора рази. Кури, які п’ють талу снігову воду, несуть в два рази більше яєць… Цей список можна і продовжити. Тала вода, як вважають багато хто, володіє особливою біологічною активністю.
Треба сказати, що океанологи давно вже звернули увагу на виняткову інтенсивність життя поблизу кромки льодів. «Врожайність» планктону в цих районах приблизно в два рази більше. І, напевно, недарма кити «пасуться» в полярних водах. Цікаве спостереження – кілька років тому в одній зі статей було показано, що кити в своїх міграціях по океану рухаються уздовж ізогалін, ліній рівної солоності. Мабуть, концентрація планктону, за яким полюють кити, залежить від зміни солоності моря при таненні льодів, а не температури води.
Взагалі вода в живому організмі, мабуть, відрізняється, більшою структурною впорядкованістю в порівнянні з вільною водою. Можливо, кажуть вчені, тала вода, що зберігає льодоподібний каркас, вимагає у зв’язку з цим менших витрат енергії на засвоєння. Втім, згідно з іншою гіпотезою, головне для живих організмів – це знижений вміст в талій воді важкого водню.
Донедавна гідрохіміків цікавили переважно глобальні проблеми, пов’язані з поширенням у Світовому океані різних елементів або їх сполук. Почасти це зрозуміло – необхідно було уявити собі загальну картину всієї величезної акваторії океану і всієї його товщі. Але ось недавно я отримав автореферат кандидатської дисертації, яка називається «дослідження особливостей хімічного складу поверхневого мікрошару морських вод і розподілу в ньому забруднюючих речовин». Автор роботи досліджує шар океану, товщина якого… менше одного міліметра. Звичайно, це принципово інший підхід… Океан під мікроскопом!
Американський вчений Роберт Хорн визнав за необхідне почати передмову до своєї книги «Морська хімія» парадоксальною фразою: «океани складаються з води». Таке нагадування не здається зайвим і сьогодні.
Необхідно ретельно і детально вивчати особливості фізико-хімічних властивостей води при самих різних умовах — у всьому діапазоні температур, тисків і так далі. Але це не самоціль. Вивчивши у всій повноті дивовижні властивості води, ми неминуче відкриємо нові явища в океані.
Автор: В. Шумілов.

