Алкани – визначення, будова, фізичні та хімічні властивості
Зміст:
Визначення
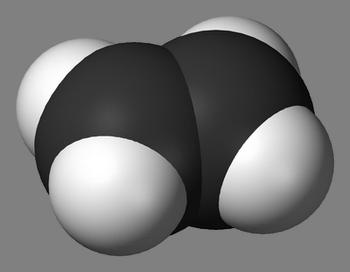
Алканами в хімії називають граничні вуглеводні, у яких вуглецевий ланцюг є незамкненим та складається з атомів вуглецю, пов’язаних один з одним за допомогою одинарних зв’язків. Також характерною особливістю алканів є те, що вони зовсім не містять подвійних або потрійних зв’язків. Часом алкани називають парафінами, справа в тому, що парафіни власне і є сумішшю граничних вуглеводнів, тобто алканів.
Формула
Формулу алкана можна записати як:
СnР2n+2
При цьому n більше або дорівнює 1.
Ізомерія
Алканам властива ізомерія вуглецевого скелета. При цьому з’єднання можуть приймати різні геометричні форми, як наприклад це показано на зображенні нижче.
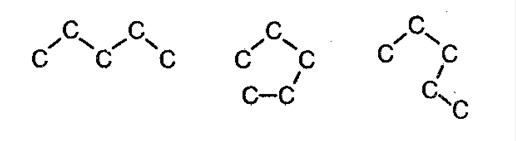
Ізомерія вуглецевого скелету
Зі збільшенням зростання вуглецевого ланцюга збільшується і кількість ізомерів. Так, наприклад, у бутану є два ізомери.
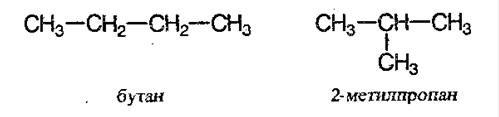
Отримання
Алкани як правило отримують різними синтетичними методами. Скажімо, один із способів отримання алкана передбачає реакцію «гідрування», коли алкани видобуваються з ненасичених вуглеводів під впливом каталізатора і при температурі.
Фізичні властивості
Алкани від інших речовин відрізняються повною відсутністю кольору, також вони не розчинні у воді. Температура плавлення алканів підвищується зі збільшенням їх молекулярної маси і довжини вуглеводневого ланцюга. Тобто чим більше розгалуженим є алкан, тим у нього більша температура горіння та плавлення. Газоподібні алкани і зовсім горять блідо-блакитним або безбарвним полум’ям, при цьому виділяючи багато тепла.
Хімічні властивості
Алкани в хімічному плані малоактивні речовини, через міцність міцних сигма зв’язків С-С і С-Н. При цьому зв’язки С-С неполярні, а С-Н малополярні. А так як все це малополярні види зв’язків, які відносяться до сигма виду, то розриватися вони будуть за гомолітичним механізмом, в результаті чого утворюються радикали. І як наслідок хімічні властивості алканів являють собою в основному реакції радикального заміщення.
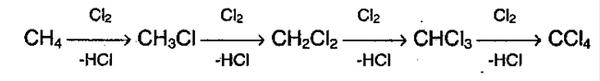
Так виглядає формула хімічної реакції радикального заміщення алканів (галогенирування алканів).
Крім цього також можна виділити такі хімічні реакції як нітрування алканів (реакція Коновалова).
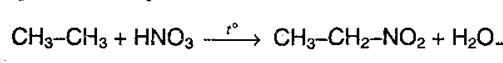
Реакція ця протікає при температурі 140 С, причому найкраще саме з третинним атомом вуглецю.
Крекінг алканів – ця реакція протікає при дії високих температур і каталізаторів. Тоді створюються умови, коли вищі алкани можуть рвати свої зв’язки утворюючи алкани нижчого порядку.
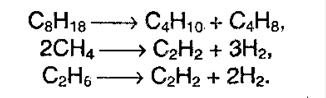
Окислення алканів – в різних умовах ця хімічна реакція може призвести до утворення спирту, альдегіду і оцтової кислоти. При повному окисленні реакція протікає аж до утворення води і вуглекислого газу.
Застосування
Алкани мають широке застосування в таких промислових сферах як синтез нафти, палива і т. д.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.

