Альдегіди: їх будова, фізичні та хімічні властивості
Зміст:
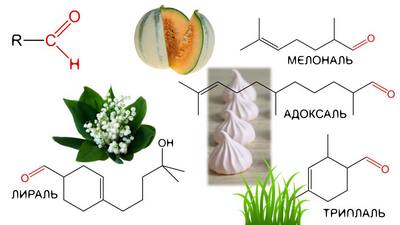
Альдегіди являють собою органічні сполуки, в яких вуглець має подвійний зв’язок з киснем і одинарний з воднем або атомом, який має позначення R в структурних схемах. Багато з альдегідів мають приємний запах, внаслідок чого знаходять активне застосування в різних промислових цілях. Отримують альдегіди зі спиртів шляхом їх дегідрування. Про їх фізичні та хімічні властивості, застосування та отримання наша сьогоднішня стаття.
Хімічні властивості
Практично всі альдегіди здатні вступати в різноманітні хімічні реакції, включаючи полімеризацію. Поєднання їх з іншими видами молекул веде до створення так званих конденсаційних полімерів, які активно використовуються, наприклад, при виробництві пластмаси, в якості розчинників і парфумерних інгредієнтів.
А деякі альдегіди навіть беруть активну участь у фізіологічних процесах, так вони є частиною:
- вітаміну А, дуже важливого для зору,
- піридоксальфосфату – однієї з форм вітаміну В6,
- глюкози та інших редукованих цукрів,
- деяких природних та синтетичних гормонів.
Важливою відмінністю альдегідів від тих же вуглеців є наявність у них карбонільної групи. Карбонільна група полярна, тобто електрони, що утворюють зв’язок С=О притягуються більше до кисню, ніж до вуглецю. Завдяки цьому перший з електронів отримує негативний заряд, а другий позитивний.
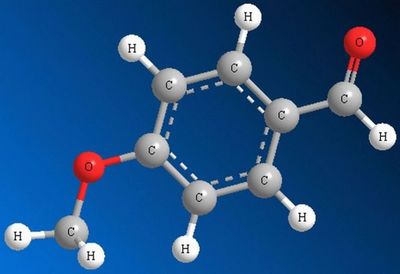
Також варто зауважити, що альдегіди мають більш високий дипольний момент в порівнянні з іншими вуглеводневими сполуками.
Фізичні властивості
Температура кипіння альдегідів і їх плавлення набагато вище у карбоніловмісних сполук, ніж у просто таких, що складаються з вуглецю і водню. Наприклад, бутан і ацетон маючи однакову молекулярну масу, закипають дуже по різному: бутан закипає вже при 0 С, в той час як ацетону для кипіння необхідно вже +56 С.
На відміну від вуглеводнів альдегіди здатні розчиняться у воді, але не всі, а тільки ті, що мають менше п’яти атомів вуглецю в молекулі. Але якщо вуглеводнева частина їх молекул вище цього числа, це робить їх нерозчинними у воді.
Структура
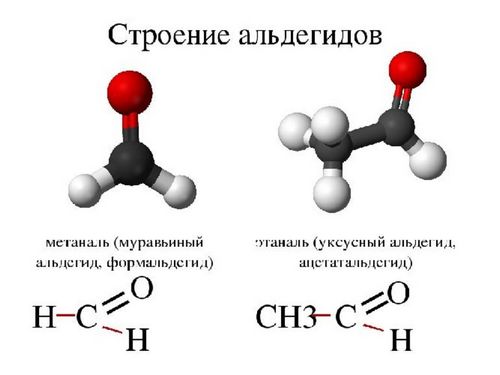
Формальгід – найпростіший альдегід, має молекулу, пов’язану з двома атомами водню. У всіх інших альдегідів молекули пов’язані лише з одним атомом водню.
Вуглець, пов’язаний з карбонільною групою може бути частиною алкільних або неалкільних груп, вони в свою чергу можуть бути ациклічними, ароматичними або гетероциклічними кільцями. Органічні сполуки, що володіють двома альдегідними групами називаються діальдегідами.
Номенклатура
Є два способи найменування альдегідів. Один з них заснований на системі, розробленій Міжнародним союзом теоретичної та прикладної хімії, його ще називають систематичною номенклатурою. Він передбачає використовувати в якості вихідного алкана найдовший ланцюг атомів вуглецю, що містить карбонільну групу в якості вихідного алкана. Числове визначення вихідної карбонільної групи при цьому використовувати не прийнято, так як вона завжди знаходиться в кінці батьківського ланцюга. Наприклад, назва може бути 2-метилбутаналь, або ізомасляний альдегід буде вказаний як 2-метилпропаналь.
Інший метод являє собою загальну номенклатуру. Принцип загальної номенклатури полягає в тому, щоб називати сполуки за загальним найменуванням відповідної карбонової кислоти. Іншими словами, структура та ж, що і у альдегіду, тільки замість CHO з’являється COOH, як у оцтової кислоти — CH3COOH або C2H4O2.
Виробництво
Так як альдегіди одні з ключових будівельних блоків органічної хімії, то не дивно, що для їх отримання та виробництва існує безліч різних методів:
- Окиснення. Являє собою один з основних методів для отримання альдегідів. Зазвичай спирти можуть бути окислені до стану альдегідів. Для цього первинний спирт пропускається через гарячий каталізатор (гідроксид міді) або через аміачний розчин оксиду срібла (так звана реакція срібного дзеркала). На жаль, але цей спосіб не підходить для маленьких лабораторій.
- Гідроформулювання – ще один спосіб для отримання альдегідів, коли алкени обробляються монооксидом вуглецю, воднем і каталізатором на основі перехідного металу.
- Один з альдегідів (ацетальдегід) може бути отриманий шляхом взаємодії ацетилену з водою.
Для комерційного отримання альдегідів найчастіше застосовують гідроформулювання.

Де і як використовуються?
Альдегіди знаходять різноманітне застосування в різних сферах людського життя. Сотні їх сполук використовуються хіміками для синтезу інших речовин. Наприклад, завдяки формальдегіду ми отримуємо формалін, який в свою чергу активно застосовується для дублення, консервації та бальзамування, а також в якості фунгіцидного та бактеріального засоби для обробки рослин.
Альдегіди, що мають високу молекулярну масу (наприклад, бензальдегід і фенілацетальдегід) володіють приємним запахом і тому використовуються в парфумерії при виробництві парфумів.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.

