Вуглець: фізичні та хімічні властивості

Зміст:
Вуглець – найважливіший хімічний елемент періодичної таблиці Менделєєва. Без нього, як і без кисню і водню немислимо було б саме Життя. Можна без перебільшення сказати, що життя всіх живих істот від амеби до людини побудоване саме з сполук вуглецю. Вуглець – біогенний елемент, що становить основу життя на нашій планеті. Будучи структурною одиницею величезного числа різних органічних сполук, він бере участь і в побудові живих організмів і в забезпеченні їх життєдіяльності. Навіть виникнення самого життя розглядається вченими як складний процес еволюції вуглецевих сполук. А які хімічні та фізичні властивості цього чудесного елемента, історія його відкриття і сучасне застосування в хімії, читайте про це далі.
Історія відкриття
Насправді вуглець був відомий людині ще з глибокої давнини у вигляді своїх алотропних модифікацій: алмазу та графіту. Крім цього вуглець у вигляді деревного вугілля активно застосовувався при виплавці металів. Від вугілля походить і сама назва вуглецю, як хімічного елемента.
Але в ті далекі часи люди користувалися вуглецем у вигляді вугілля, або милувалися ним же, у вигляді алмазів, не усвідомлено, без розуміння того, який важливий хімічний елемент стоїть за всім цим.
Наукове відкриття вуглецю відбулося в 1791 році, коли англійський хімік Теннант вперше отримав вільний вуглець. Для отримання вуглецю він пропускав пари фосфору над прожареною крейдою. В результаті цієї хімічної реакції утворилися фосфат кальцію і чистий вуглець. Втім, цьому досліду передували й інші шукання, наприклад видатний французький хімік Лавуазьє поставив дослід зі спалювання алмазу за допомогою великої запальної машини. Дорогоцінний алмаз згорів без залишку, після чого вчений прийшов до висновку, що алмаз являє собою ніщо інше як кристалічний вуглець.

Цікаво, що в цих дослідах спільно з алмазом пробували спалювати й інші дорогоцінні камені, наприклад, рубін. Але інші камені витримували високу температуру, тільки алмаз згорав без залишку, що і звернуло увагу на його відмінну хімічну природу.
Місце в таблиці Менделєєва
В основі розташування хімічних елементів в періодичній системі Менделєєва лежить їх атомна вага, розрахована щодо атомної ваги водню. Атомна маса вуглецю становить 12,011, згідно з нею він займає почесне 6-е місце в таблиці Менделєєва і позначається латинською літерою С.

Крім цього слід звернути увагу на наступні характеристики вуглецю:
- Природний вуглець складається з суміші двох стабільних ізотопів 12С (98,892%) і 13С (1,108%)
- Крім цього відомо 6 радіоактивних ізотопів вуглецю. Один з них, ізотоп 14С з періодом напіврозпаду 5,73*103 років в невеликих кількостях утворюється у верхніх шарах атмосфери нашої планети під дією космічного випромінювання.
Будова атома
Атом вуглецю має 2 оболонки (як втім, і всі елементи, розташовані в другому періоді) і 6 електронів: 1s22s22p2. Чотири валентних електрона знаходяться на зовнішньому електронному рівні атома вуглецю. А інші два електрони знаходяться на окремих p-орбіталях, при цьому вони є неспареними.
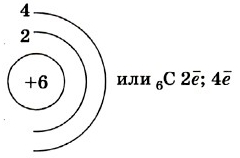
Так на картинці зображена схема електронної будови атома вуглецю.
Фізичні властивості
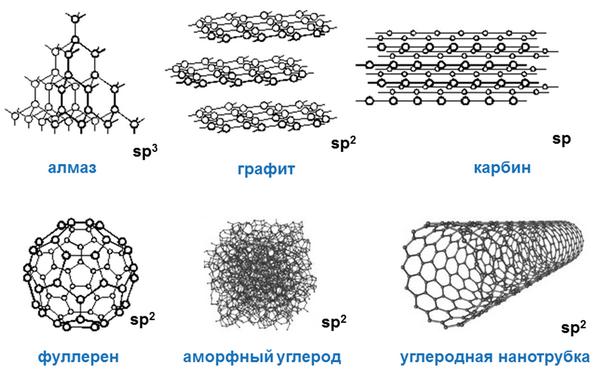
Своїми фізичними властивостями вуглець типовий неметал. При цьому він утворює безліч алотропних модифікацій («алотропні» означає існування двох і більше різних речовин з одного хімічного елемента): найбільш популярними з них є алмаз, графіт, вугілля, сажа. При цьому алмаз – одна з найбільш твердих речовин, що представляють вуглець.
Зрозуміло, різні алотропні модифікації вуглецю мають і різні фізичні властивості. Якщо алмаз типове тверде тіло, то, наприклад, рідкий вуглець, який можна отримати тільки при певному зовнішньому тиску, володіє зовсім іншими фізичними властивостями, ніж алмаз або графіт.
Хімічні властивості
У звичайних умовах вуглець, як правило, хімічно інертний, але при високих температурах він може вступати в хімічні взаємодії з багатьма іншими елементами, зазвичай проявляючи сильні відновні властивості. Наведемо приклади хімічних реакцій вуглецю як відновника з:
– з киснем
C0 + O2 –t°= CO2 вуглекислий газ
при нестачі кисню – неповне згоряння:
2C0 + O2 –t°= 2C+2O чадний газ
– з фтором
С + 2F2 = CF4
– з водяною парою
C0 + H2O –1200°= С+2O + H2 водяний газ
– з оксидами металів. Таким чином, виплавляють метал з руди.
C0 + 2CuO –t°= 2Cu + C+4O2
– з кислотами-окислювачами:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
– з сіркою утворює сірковуглець:
С + 2S2 = СS2.
Часом вуглець може виступати і як окислювач, утворюючи карбіди при вступі в хімічні реакції з деякими металами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступаючи в реакцію з воднем, вуглець утворює метан:
C0 + 2H2 = CH4
Місце в природі
У земній корі вміст вуглецю становить всього лише 0,15%. Незважаючи на цю уявну маленьку цифру, варто зауважити, що вуглець безперервно бере участь в природному кругообігу із земної кори через біосферу в атмосферу і навпаки. Також саме з вуглецю складаються такі цінні ресурси як нафта, вугілля, торф, вапняки і природний газ. І як ми писали на початку нашої статті, вуглець – основа життя. Скажімо, в тілі дорослої людини з вагою в 70 кг є близько 13 кг вуглецю. Це тільки в одній людини, приблизно в таких же пропорціях вуглець міститься в тілах всіх інших живих істот, рослин і тварин.
Застосування
Можна сказати, що вуглець нерозривно пов’язаний з самим розвитком людської цивілізації. Саме із сполук за участю вуглецю утворені основні палива, завдяки яким їздять машини, літають літаки, ви можете приготувати собі їжу і обігріти свій будинок в холодну пору – це нафта і газ. Крім цього сполуки вуглецю активно використовуються в хімічній і металургійній промисловості, у фармацевтиці та будівництві. Алмази, будучи алотропною модифікацією вуглецю використовуються в ювелірній справі і ракетобудуванні. В цілому промисловість сучасності не може обійтися без вуглецю, він необхідний практично скрізь.
Рекомендована література та корисні посилання
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.

