Фосфор: фізичні та хімічні властивості

Зміст:
Кожна людина знайома з 15 елементом таблиці Менделєєва – фосфором, адже кожен у своєму житті хоча б раз користувався сірниками, що мають фосфор в своєму складі. Більш того, всі люди мають фосфор у своєму організмі, не в чистому вигляді, звісно, а у вигляді хімічних сполук, але тим не менш. Особливо багато фосфору знаходиться в наших кістках і зубах, чий хімічний склад майже повністю співпадає з формулою мінералу фосфориту Ca3(PO4)2.Також фосфоровмісні білки знаходяться в наших м’язах, нервах і мозковій тканині, саме тому фосфор особливо корисний для мозку. Про фізичні та хімічні властивості цього важливого хімічного елемента, про його застосування і вплив на людину читайте далі.
Історія відкриття
У 1669 гамбурзький купець і за сумісництвом алхімік Хенніг Брандт в черговий раз намагався здійснити мрію всіх середньовічних алхіміків – знайти легендарний філософський камінь, що нібито перетворює всі метали в золото і дарує безсмертя. На жаль, філософський камінь і цього разу знайти не вдалося, але, тим не менш, Хеннігу пощастило зробити інше не менш важливе відкриття в хімії. На цей раз в якості експерименту німецький алхімік вирішив випаровувати воду з… людської сечі. В результаті низки складних хімічних маніпуляцій над власною сечею в реторті у алхіміка утворилася невідома до того світна речовина – фосфор.
До слова, саме слово «фосфор» з давньогрецької перекладається як «несучий світло». Саме таку назву він отримав за свою дивовижну здатність світитися в темряві. Першовідкривач фосфору алхімік Хенніг Брандт швидко зрозумів свою вигоду від цього відкриття і за великі гроші показував світний фосфор різним шляхетним та багатим панам, наживши при цьому великі статки (розваг у той час в Європі було не так вже й багато, так що науково-популярні вистави підприємливого алхіміка користувалися великим попитом).

Втім, Хенінг Брандт був не першим, хто добув фосфор дослідним шляхом. Ще до нього, в XII столітті це вдалося зробити арабському алхіміку Алхіду Бехілу, все також завдяки хімічним маніпуляціям з сечею і глиною, але його відкриття загубилося, і саме повторне відкриття фосфору німецьким алхіміком принесло широку популярність цьому хімічному елементу.
Перший час після відкриття фосфор викликав лише цікавість своїм світінням і тільки в кінці XIX століття вчені зрозуміли, що фосфор також є надзвичайно важливим корисним мікроелементом для життєдіяльності людського організму.
Фізичні властивості
Як і азот, фосфор здатний утворювати двохатомні молекули Р2. Однак подібні молекули фосфору можуть бути стійкими лише при дуже високій температурі – близько 1000 С. У звичайних умовах атоми фосфору з’єднуються в молекули інших складів. Наприклад, білий фосфор складається з чотирьохатомних молекул Р4. Між собою атоми білого фосфору з’єднані у вигляді найпростішого багатогранника тетраедра.
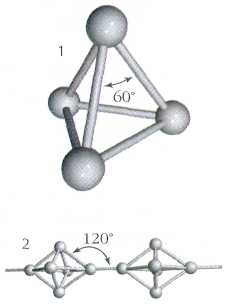
Так схематично виглядає будова молекули білого фосфору, що складається з чотирьох атомів.
Сам білий фосфор являє собою практично безбарвну твердокристалічну речовину, що моментально окислюється киснем повітря, при цьому під час окислення фосфору йде дим, а в повітрі з’являється явний часниковий запах. Своїм зовнішнім виглядом білий фосфор схожий на віск, такий же м’який, легкоплавкий, при цьому світиться в темряві і є надзвичайно небезпечним, так як дуже отруйний та вогненебезпечний.
Крім білого фосфору фізики також розрізняють червоний фосфор, чорний фосфор, жовтий фосфор і металевий фосфор, кожен з них має свої особливі фізичні властивості.
Так якщо білий фосфор нагрівати до температури 300 С без доступу повітря в присутності каталізаторів (ними може бути йод або натрій), то він перетвориться в червоний фосфор. На відміну від білого фосфору його червоний побратим не світиться в темряві і не є отруйним та небезпечним, до слова саме його використовують при виробництві сірників.

Червоний фосфор це аморфна речовина, що складається з полімерних молекул Px, він не розчиняється у воді та інших органічних розчинниках, а при нагріванні без доступу повітря не займається.
Якщо білий фосфор помістити під дуже великий тиск (в сотні атмосфер) то з нього вийде чорний фосфор, який за своїми властивостями нагадує метал: він блищить і проводить електричний струм. Якщо ще більше збільшити тиск, то чорний фосфор перетвориться в металевий, його кристалічна решітка буде такою ж щільною як у металів. Металевий фосфор дуже добре проводить електричний струм.

Так виглядають різні види фосфору.
Хоча фосфор і є одним з найпоширеніших хімічних елементів на нашій планеті, в чистому вигляді в природних умовах його не буває, добути чистий фосфор можливо лише в хімічній лабораторії. Однак фосфор входить до складу багатьох важливих хімічних і біологічних сполук: фосфоліпідів, фосфидів (сполуки фосфору та металів), фосфінів (сполук водню з фосфором), фосфорної кислоти і так далі.
Хімічні властивості
Як ми писали вище, фосфор займає 15 місце в періодичній таблиці Менделєєва і входить в одну групу з азотом, миш’яком та сурмою. Хоча на валентному рівні він і має цілих 5 електронів, проте 5 зв’язків утворюються досить рідко.

Фосфор дуже хімічно активний елемент, особливо білий фосфор. Як наслідок, він може вступати в найрізноманітніші хімічні реакції, виступаючи в якості окислювача (з елементами, розташованими нижче і лівіше в таблиці Менделєєва), так і відновника (з елементами, розташованими вище і правіше в таблиці Менделєєва).
При взаємодії з киснем повітря утворюються оксиди – ангідриди відповідних кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаємодії фосфору з галогенами утворюються галогеніди із загальною формулою PHal3 і PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаємодії фосфору з сіркою утворюються сульфіди:
2P + 3S > P2S3
2P + 5S > P2S5
При взаємодії з металами фосфор проявляє властивості окислювача, продукти реакції називають фосфідами.
Наприклад, кальцій і магній реагують з фосфором з утворенням фосфідів кальцію та магнію:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Застосування
Навчившись добувати фосфор в чистому вигляді людина знайшла йому найрізноманітніше застосування, причому не тільки творче, але часом і дуже руйнівне. Так ще під час Першої світової війни німецькими хіміками був використаний жовтий фосфор в якості начинки запальних боєприпасів та отруйних газів.

Згодом застосування таких газів на полі бою було заборонено Женевською конвенцією. На жаль, така наша дурна людська природа – використовувати наукові відкриття в руйнівних цілях, як втім, і відкриття енергії розщеплення атома було застосовано для створення атомної бомби, і лише потім для атомної енергетики.
Але повернімося до фосфору, в мирних цілях цей хімічний елемент активно використовується в сільському господарстві для створення ефективних добрив для рослин. Фосфор входить до складу деяких лікарських препаратів, наприклад, в антибіотик фосфоміцин, до складу миючих засобів, нарешті, з безпечного червоного фосфору роблять сірники.
Фосфор має своє застосування і в металургії, в якості надміцних і антикорозійних покриттів (чорний і металевий фосфор). А багато фосфідів (сполук фосфору та металів) володіють відмінними напівпровідниковими властивостями і активно застосовуються в мікроелектроніці.
Отримання
Для отримання білого фосфору в чистому вигляді хіміки проколюють природні фосфати разом з коксом і піском в електричній печі. Втім, замість фосфатів можна використовувати й інші неорганічні сполуки фосфору, наприклад, метафосфорну кислоту. Червоний і чорний фосфор отримують вже з білого фосфору шляхом різних маніпуляцій над останнім (нагрівання, збільшення тиску).

Дія, функції та роль в організмі людини
Тепер давайте відповімо на питання, яка роль фосфору в організмі людини. А вона дуже велика, так як фосфор бере участь у всіх обмінних процесах, що відбуваються в нашому організмі. Основна маса фосфору знаходиться в кістках і зубах. Спільно з кальцієм фосфор формує правильну структуру кісткової тканини, і якщо пропорція вмісту кальцію та фосфору буде порушена, то кістки можуть стати крихкими, збільшиться ризик переломів.
Крім кісток і зубів фосфор має вплив і на найголовніше – розумову діяльність людини, адже він міститься в нашій мозковій тканині і нервах. Від фосфору залежить робота нервової системи, з його допомогою здійснюється метаболізм ліпідів та протеїнів, біосинтез всіх необхідних органічних речовин. Нарешті фосфор входить до складу ДНК і РНК, бере участь у ферментивних процесах, що підтримують кислотно-лужний баланс в організмі.
Для дитини
Особливо необхідний фосфор для зростаючого дитячого організму, адже у дитини йде активне формування кісток скелета, розвиваються клітини головного мозку. Тому дуже важливо, щоб малюк отримував фосфор у необхідних кількостях і при цьому регулярно, адже значна його частина вимивається з організму з сечею.
Тому важливо знати, які продукти містять фосфор.
Продукти, що містять
На щастя фосфор міститься в багатьох доступних продуктах харчування: горіхах, морепродуктах (особливо в рибі), в сирі, капусті, моркві, часнику, курячих яйцях (особливо в жовтку). Особливо багато фосфору є в яблуках, волоських горіхах, яловичій печінці, гречці та ікрі риб сімейства осетрових.

Тепер ви знаєте, які продукти можуть збільшити вміст фосфору у вашому організмі і організмі ваших дітей.
Добова норма
Добова норма фосфору для дорослої людини становить 1200-1600 мг. Також варто врахувати, що для людей, що займаються інтенсивними фізичними навантаженнями, а також для вагітних і годуючих матерів добова норма фосфору вище і складає приблизно 3000-3800 мг.
Дітям потрібно від 300 до 1800 мг фосфору щодня, в залежності від їх віку.
Дефіцит в організмі
Дефіцит фосфору в людському організмі може бути обумовлений різними причинами:
- прийомом деяких ліків, які знижують кислотність,
- дієтами зі зниженим вмістом білків,
- алкогольними або наркотичними залежностями,
- ендокринними захворюваннями,
- захворюваннями нирок.
Симптомами нестачі фосфору є загальне нездужання, слабкість, апатичність, депресія, фізичне і розумове виснаження. Якщо у вас проявляються ці симптоми, то краще чим швидше звернутися до лікаря, щоб він прописав вам правильне лікування.
Надлишок в організмі і симптоми отруєння
Надлишок фосфору в людському організмі може бути настільки ж шкідливим, як і його дефіцит. Зазвичай причиною надлишку фосфору є зловживання людиною м’ясною їжею. Коли фосфору стає занадто багато, порушується його пропорція вмісту з кальцієм. Кальцію стає менше ніж потрібно, його витісняє фосфор, від чого кістки людини стають більш крихкими, може виникнути остеопороз (зниження щільності кісток, підвищення їх крихкості).
Також надлишок фосфору може призвести до виникнення проблем із зубами, порушення роботи нервової системи, нирок і щитовидних залоз. Щоб запобігти цьому важливо вести здоровий спосіб життя, правильно харчуватися (не самим лише хлібом і м’ясом, а обов’язково фруктами, овочами), уникати шкідливих звичок.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.


Дякую!