Металлы внутри нас
«У него в жилах течет голубая кровь», — говорили в свое время об аристократах. Да и сейчас еще говорят — в шутку. Пришло это выражение из Испании, где белая кожа и хорошо видные кровеносные сосуды с голубым оттенком считались признаком благородства: ведь рядом жили мавры с черной кожей. А бывает ли на самом деле кровь голубого цвета? Бывает, только не у людей, а у беспозвоночных животных: раков, моллюсков, морских червей, осьминогов… Красный цвет нашей крови придает железо.
Но в этой статье нам предстоит столкнуться с «золотой» и с «медной» кровью. Металлы в крови? Нет, не только в крови, в живых организмах их можно найти во всех сложных белковых молекулах-ферментах. О ферментах — биологических катализаторах в последнее время пишут все больше и больше. Да и как не удивляться этим веществам: они ускоряют реакции в десятки и в сотни миллионов раз. Известно, что химики применяют катализаторы. Но разве можно сравнить их по действию с ферментами?
Вот всего один пример. Перекись водорода разлагается под влиянием железа. Если бы у нас был один атом железа и один атом фермента каталазы, выделенный из печени быка, и если бы мы попробовали сравнить, за какое время они разложат одинаковое количество перекиси водорода, то в этом соревновании первенство было бы, несомненно, за ферментом каталазой. То, что каталаза сделает за одну секунду, атом железа сделает только за 300 лет. В чем же магическая сила фермента? В его сердце.
Что такое «сердце» фермента, можно понять, если хорошо знаешь, как построена его молекула. Биохимики уже построили модели многих ферментов. Вот перед нами модель гемоглобина.
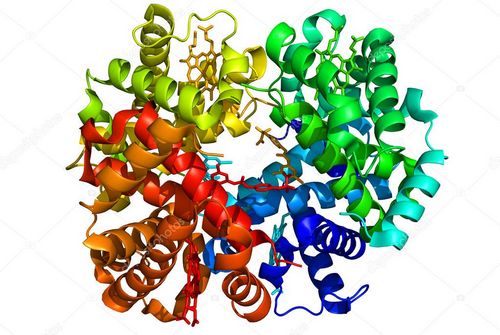
Ее составляют 10 000 атомов. Это четыре белковых цепи, каждая из которых закручена в спираль. Сложно изогнутые, они, как пальцы руки, растопырены в пространстве, в середине — самый активный участок гем с атомом железа. Но гемоглобин это наиболее примитивная модель фермента, другие ферменты построены во много раз сложнее. Их можно представить уже как огромные клубки из белковых цепей. Вначале кажется, что клубки эти беспорядочно намотаны вокруг своего центра. На самом деле каждая нить в каждом ферменте уложена в строго определенном порядке. И это далеко не все. Модели фермента, построенные с помощью рентгеноструктурного анализа, — это кадр, выхваченный из динамичных колебаний живых молекул. Вот почему, если бы нам удалось посмотреть на молекулу фермента в действии, мы бы ничего не увидели… кроме облачка. Это пульсируют молекулы.
Некоторые биофизики считают, что колебания белковых цепей происходят с частотой 30—30 000 герц. Если так, то молекулы в живом организме попросту поют, звучат на той или другой ноте: ведь это интервал звуковых частот. Сторонники этой гипотезы считают даже, что со временем удастся «слушать» молекулы живого организма и по изменению, звука узнавать о начале болезни.
Несмотря на то, что клубки ферментов вибрируют со звуковой частотой, они сохраняют свою структуру: нити белка как бы взвешены в пространстве. Множество сил удерживает их — и электрические, и электромагнитные, и просто магнитные, создаваемые атомом металла.
Использовать атомные магнитные поля — пока мечта человека. В природе же атомный магнитный вибратор уже существует почти столько же, сколько существует и жизнь. Это молекула фермента. Можно предположить, что в центре молекулы атом металла — как бы магнит, от которого отталкиваются маленькие магнитики, разбросанные по белковым нитям клубка. Молекула фермента не только магнитный вибратор, но и сложная вычислительная машина: она начинает действовать, только столкнувшись с определенным субстратом.
Прежде всего о постоянном магните, сидящем в центре, о металле. Это лишь один атом какого-нибудь тяжелого металла: меди, железа, цинка, свинца, кобальта, золота… Вокруг атома металла образуется мощнейшее магнитное поле с напряженностью до 300 000 эрстед, правда, действует оно на небольшое расстояние, но, по-видимому, вполне достаточное, чтобы в его зону попали все отростки фермента. Белковые цепи, как миниатюрные пружины с навешенными на них магнитиками, окружают металл. Итак, фермент готов к реакции, все его части напряжены, они находятся в неустойчивом равновесии, которое сразу же нарушится, стоит только появиться «знакомой» ему молекуле. Американский исследователь Ж. П. Шанже считает, что способность фермента «узнавать» необходимые ему для реакции вещества отточилась до совершенства путем естественного отбора.
В живом организме нет моментов, когда фермент в бездействии. Или почти нет. Гипотетически все это можно представить так. Первое же движение зарядов белковых спиралей создает магнитное поле, оно взаимодействует с постоянным магнитным полем атома металла. Преобладание положительных или отрицательных зарядов, в свою очередь, приводит к закручиванию или раскручиванию спирали. Будет ли вся спираль отбрасываться от центра или притягиваться к нему, зависит от преобладающего знака заряда, а следовательно, от порядка набора аминокислот в спирали, то есть от генетической информации, заложенной в ферменте.
Отброшенные магнитным и электростатическим полем белковые цепи перестают раскручиваться. Теперь преобладают силы скручивания, все заряды начинают вращаться в другую сторону, возникает магнитное поле с другим направлением. Спираль с силой притягивается, сжимается и снова стремится раскрутиться. Все это слегка напоминает детскую игрушку, когда в пуговицу продето несколько ниток. Если скрутить нитки и потянуть, пуговица начнет вращаться и силой энергии снова закрутит нитки в противоположную сторону. Опять потянуть за нитки — пуговица снова начнет вращаться.
Таким образом, фермент выступает как микроскопический вибратор, возбуждающий вокруг себя среду и ускоряющий реакции между веществами в десятки и сотни тысяч раз. Но фермент не просто вибрирует среду, своей микровибрацией он как бы притирает одно вещество с другим. После того, как он сделал свое дело, фермент освобождается, и начинается все сначала.
Достаточно молекулу фермента лишить атома металла, попросту вырвать его оттуда, как пульсация прекращается. Еще совсем недавно белковые цепочки ферментативного клубка были напряжены, как бы накачаны воздухом, теперь они слиплись, спали и безжизненно плывут в жидкости, содрогаясь от беспорядочных ударов молекул окружающей среды.
Такая же история происходит и с теми ферментами, что лишены собственного атома металла, а используют магнитное и электростатическое поле окружающих их ионов кальция или магния. Стоит только удалить эти ионы — и ферменты перестают работать. Возможно, здесь, уже на молекулярном уровне, лежит граница между живым и неживым. Одни молекулы пульсируют, другие неподвижны, безжизненны.
Автор: Ю. Симаков.

