Ортофосфорная кислота, ее применение и строение

Фосфорная кислота, также называемая ортофосфорной кислотой (H3PO4), наиболее важная кислородная кислота фосфора, используемая ради получения фосфатных солей для удобрений. Она также применяется в стоматологических цементах, при производстве производных альбумина, а также в сахарной и текстильной промышленности. Помимо этого она служит в некоторых пищевых продуктах как кислый фруктовый ароматизатор и пищевая добавка (под кодовым именем Е338).
(К слову если вы ищете, где лучше ортофосфорную кислота купить, то переходите по ссылке).
Строение фосфористой кислоты
Ортофосфорную кислоту H3PO3 обычно называют просто фосфорной кислотой. В чистом виде это бесцветное кристаллическое твердое вещество.
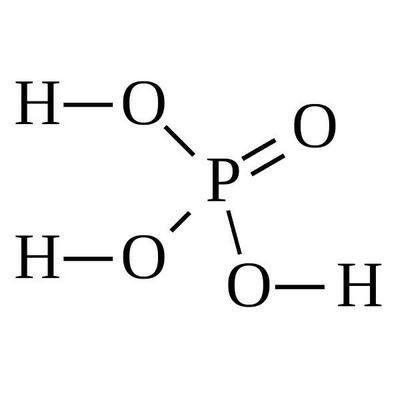
Чистая фосфорная кислота представляет собой твердое кристаллическое вещество (точка плавления 42,35 °C или 108,2 ° F); в менее концентрированном виде походит на бесцветную сиропообразную жидкость. Неочищенную кислоту получают из фосфатной руды, а кислоту более высокой чистоты — из белого фосфора.
Фосфорная кислота образует три класса солей, соответствующих замещению одного, двух или трех атомов водорода. Среди важных фосфатных солей: дигидрофосфат натрия (NaH2PO4), используемый для контроля концентрации водородных ионов (кислотности) растворов; гидрофосфат динатрия (Na2HPO4), используемый при очистке воды в качестве осадителя для сильно заряженных катионов металлов; тринатрийфосфат (Na3PO4), используемый в мыле и моющих средствах; дигидрофосфат кальция или суперфосфат кальция (Ca [H2PO4]2) — это основной ингредиент удобрений; моногидрофосфат кальция (CaHPO4), используемый в качестве кондиционирующего агента для солей и сахаров.
Молекулы фосфорной кислоты взаимодействуют в подходящих условиях, часто при высоких температурах, с образованием более крупных молекул (обычно с потерей воды). Таким образом, дифосфорная или пирофосфорная кислота (H4P2O7) образуется из двух молекул фосфорной кислоты, за вычетом одной молекулы воды. Это простейший из гомологического ряда длинноцепочечных молекул, называемых полифосфорными кислотами.
Известные метафосфорные кислоты характеризуются циклической молекулярной структурой. Термин метафосфорная кислота также используется для обозначения вязкого липкого вещества, которое представляет собой смесь длинноцепочечных и кольцевых форм (HPO3). Различные полимерные формы фосфорной кислоты также получают путем гидратации оксидов фосфора.

