Ковалентний зв’язок: полярний, неполярний, механізми його появи
Содержание:
Визначення та характеристика
Сам термін «ковалентний зв’язок» походить від двох латинських слів: «со» – спільно і «vales» – той, що має силу, так як цей зв’язок відбувається за рахунок пари електронів, що належать одночасно обом атомам (або кажучи більш звичною мовою, зв’язок між атомами за рахунок пари електронів, які є загальними для них). Утворення ковалентного зв’язку відбувається виключно серед атомів неметалів, причому з’являтися він може як в атомах молекул, так і кристалів.
Вперше ковалентний хімічний зв’язок була виявлений в далекому 1916 році американських хіміком Дж. Льюїсом і деякий час існував у вигляді гіпотези, ідеї, лише потім була підтверджений експериментально. Що ж з’ясували хіміки з цього приводу? А те, що електронегативність неметалів буває досить великою і при хімічній взаємодії двох атомів перенесення електронів від одного до іншого може бути неможливим, саме в цей момент і відбувається об’єднання електронів обох атомів, між ними виникає справжній ковалентний зв’язок атомів.
Типи зв’язку
В цілому є два типи ковалентного зв’язку:
- обмінний,
- донорно-акцептний.
При обмінному типі ковалентного зв’язку між атомами кожен з пов’язаних атомів представляє на утворення електронного зв’язку по одному неспареному електрону. При цьому електрони ці повинні мати протилежні заряди (спіни).
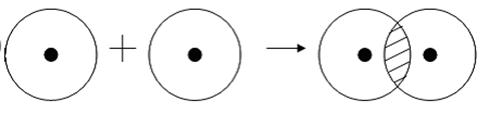
Прикладом подібного ковалентного зв’язку можуть бути зв’язки, що відбуваються молекулі водню. Коли атоми водню зближуються, їх електронні хмари проникають одна в одну, в науці це називається перекриванням електронних хмар. Як наслідок, електронна щільність між ядрами збільшується, самі вони притягуються один до одного, а енергія системи зменшується. Проте, при дуже близькому наближенні ядра починають відштовхуватися, і таким чином виникає деяка оптимальна відстань між ними.
Більш наочно це показано на картинці.
Що ж стосується донорно-акцепторного типу ковалентного зв’язку, то він відбувається коли одна частинка, в даному випадку донор, представляє для зв’язку свою електронну пару, а друга, акцептор – вільну орбіталь.
Також говорячи про типи ковалентного зв’язку можна виділити неполярний та полярний ковалентні зв’язки, більш докладно про них ми напишемо нижче.
Неполярний зв’язок
Визначення ковалентного неполярного зв’язку просте, це зв’язок, який утворюється між двома однаковими атомами. Приклад утворення неполярного ковалентного зв’язку дивіться нижче на схемі.
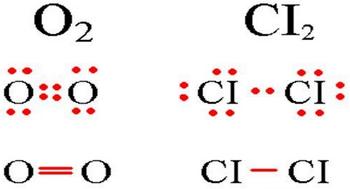
Схема ковалентного неполярного зв’язку.
У молекулах при ковалентному неполярному зв’язку загальні електронні пари розташовуються на однаковій відстані від ядер атомів. Наприклад, в молекулі кисню (на схемі вище), атоми набувають восьми електронну конфігурацію, при цьому вони мають чотири загальні пари електронів.
Речовинами з ковалентним неполярним зв’язком зазвичай є гази, рідини або порівняно низькоплавні тверді речовини.
Полярний зв’язок
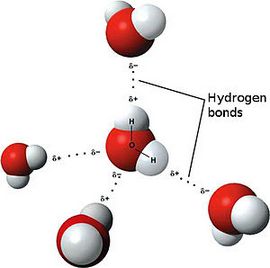
Тепер же відповімо на питання який зв’язок ковалентний полярний. Отже, ковалентний полярний зв’язок утворюється, коли ковалентно пов’язані атоми мають різну електронегативність, і громадські електрони не належать в рівній мірі двом атомам. Велику частину часу громадські електрони перебувають ближче до одного атома, ніж до іншого. Прикладом ковалентного полярного зв’язку можуть служити зв’язки, що виникають в молекулі хлороводню, там громадські електрони, відповідальні за утворення ковалентного зв’язку розташовуються ближче до атому хлору, ніж водню. А вся справа в тому, що електронегативність у хлору більше ніж у водню.

Так виглядає схема ковалентного полярного зв’язку.
Яскравим прикладом речовини з полярним ковалентним зв’язком є вода.
Як визначити зв’язок
Що ж, тепер ви знаєте відповідь на питання як визначити ковалентний полярний зв’язок, і як неполярний, для цього достатньо знати властивості і хімічні формули молекул, якщо ця молекула складається з атомів різних елементів, то зв’язок буде полярним, якщо з одного елемента, то неполярним . Також важливо пам’ятати, що ковалентні зв’язки в цілому можуть виникати тільки серед неметалів, це обумовлено самим механізмом ковалентних зв’язків, описаним вище.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.
Ця стаття доступна англійською мовою – Covalent Bond.

