Електролітична дисоціація: теорія і основні положення
Зміст:
Історія
Історія відкриття такого цікавого явища в хімії як електролітична дисоціація почалася в 1887 році, коли шведський хімік Сванте Аренніус під час досліджень електропровідності водних розчинів, висловив припущення, що в подібних розчинах речовини можуть розпадатися на заряджені частинки – іони. Іони ці перебувають у русі, пересуваючись до електродів, як позитивно зарядженого катода, так і негативно зарядженого анода. Цей процес розпаду і отримав назву електролітичної дисоціації, саме він є причиною появи електричного струму в розчинах.
Теорія
Класична теорія електролітичної дисоціації, розроблена першовідкривачем С. Аренніусом спільно з В. Освальдом, перш за все, припускала, що розпад молекул на іони (власне дисоціація) відбувається під дією електричного струму. Згодом з’ясувалося, що це не зовсім так, оскільки було виявлено існування іонів у водних розчинах, незалежно від того, проходив через них струм чи ні. Тоді Сванте Аренніус сформував нову теорію, суть її полягає в тому, що електроліти мимовільно розпадаються на іони під впливом розчинника. А вже наявність іонів створює ідеальні умови для електропровідності в розчині.
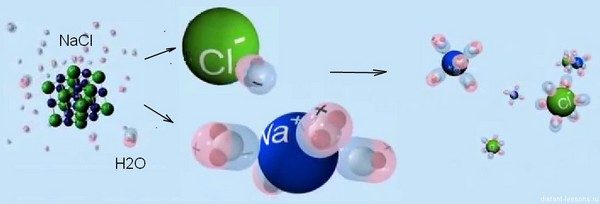
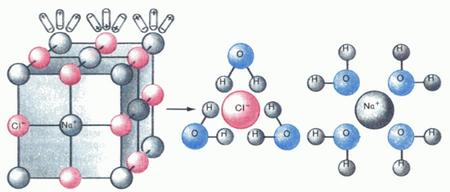
Приблизно так виглядає електролітична дисоціація схематично.
Велике значення електролітичної дисоціації в розчинах полягає в тому, що вона дозволяє описувати властивості кислот, основ і солей, і далі ми детально на цьому зупинимося
Дисоціація кислот
Кислотами прийнято вважати електроліти, при дисоціації яких в якості катіонів, утворюються виключно катіони водню.
Н3РО4 ⇄ Н + Н2РО—4 (перша ступінь)
Н2РО4 ⇄ Н + НРO2–4 (друга ступінь)
Н2РО4 ⇄ Н+ PОЗ—4 (третя ступінь)
Так виглядають хімічні рівняння електролітичної дисоціації кислот. У прикладі показана електролітична дисоціація фосфорної кислоти Н3РО4 яка розпадається на водень H (катіон) і іони анодів. Причому дисоціація багато основних кислот проходить, як правило, тільки по першій ступені.
Дисоціація основ
Основи відрізняються від кислот тим, що при їх дисоціації в якості катіонів утворюються гідроксид-іони.
Приклад рівняння хімічної дисоціації підстав
KOH ⇄ K + OH—; NH4OH ⇄ NH+4 + OH—
Основи, які розчиняються у воді, називають лугами, їх не так вже й багато, в основному це основи лужних і лужноземельних металів, таких як LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2
Дисоціація солей
При електролітичній дисоціації солей в якості катіонів утворюються метали, а також катіон амонію NH4, а аніонами стають кислотні залишки.
(NH4)2SO4 ⇄ 2NH+4 + SO2–4; Na3PO4 ⇄ 3Na + PO3-4
Приклад рівняння електролітичної дисоціації солей.

Автор: Павло Чайка, головний редактор журналу Пізнавайка
При написанні статті намагався зробити її максимально цікавою, корисною та якісною. Буду вдячний за будь-який зворотний зв'язок та конструктивну критику у вигляді коментарів до статті. Також Ваше побажання/питання/пропозицію можете написати на мою пошту pavelchaika1983@gmail.com або у Фейсбук.

