Метали всередині нас
“У нього в жилах тече блакитна кров”, – говорили свого часу про аристократів. Та й зараз ще кажуть — в жарт. Прийшов цей вислів з Іспанії, де біла шкіра і добре видні кровоносні судини з блакитним відтінком вважалися ознакою шляхетності: адже поруч жили маври з чорною шкірою. А чи буває насправді кров блакитного кольору? Буває, тільки не у людей, а у безхребетних тварин: раків, молюсків, морських хробаків, восьминогів… Червоний колір нашій крові надає залізо.
Але в цій статті нам належить зіткнутися з «золотою» і з «мідною» кров’ю. Метали в крові? Ні, не тільки в крові, в живих організмах їх можна знайти у всіх складних білкових молекулах-ферментах. Про ферменти — біологічні каталізатори останнім часом пишуть все більше і більше. Та й як не дивуватися цим речовинам: вони прискорюють реакції в десятки і в сотні мільйонів разів. Відомо, що хіміки застосовують каталізатори. Але хіба можна порівняти їх за дією з ферментами?
Ось всього один приклад. Перекис водню розкладається під впливом заліза. Якщо б у нас був один атом заліза і один атом ферменту каталази, виділений з печінки бика, і якщо б ми спробували порівняти, за який час вони розкладуть однакову кількість перекису водню, то в цьому змаганні першість була б, безсумнівно, за ферментом каталази. Те, що каталаза зробить за одну секунду, атом заліза зробить тільки за 300 років. У чому ж магічна сила ферменту? В його серці.
Що таке «серце» ферменту, можна зрозуміти, якщо добре знаєш, як побудована його молекула. Біохіміки вже побудували моделі багатьох ферментів. Ось перед нами модель гемоглобіну.
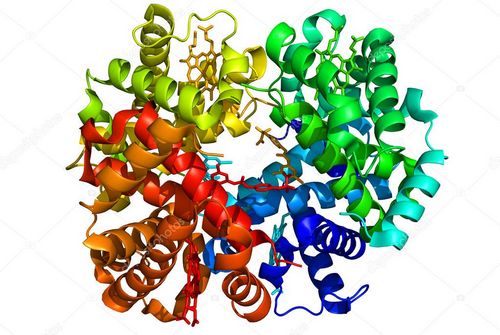
Її становлять 10 000 атомів. Це чотири білкових ланцюга, кожний з яких закручений в спіраль. Складно вигнуті, вони, як пальці руки, розчепірені в просторі, в середині – найактивніша ділянка гем з атомом заліза. Але гемоглобін це найбільш примітивна модель ферменту, інші ферменти побудовані у багато разів складніше. Їх можна уявити вже як величезні клубки з білкових ланцюгів. Спочатку здається, що клубки ці безладно намотані навколо свого центру. Насправді кожна нитка в кожному ферменті покладена в строго певному порядку. І це далеко не все. Моделі ферменту, побудовані за допомогою рентгеноструктурного аналізу, — це кадр, вихоплений з динамічних коливань живих молекул. Ось чому, якби нам вдалося подивитися на молекулу ферменту в дії, ми б нічого не побачили… крім хмарки. Це пульсуючі молекули.
Деякі біофізики вважають, що коливання білкових ланцюгів відбуваються з частотою 30-30 000 герц. Якщо так, то молекули в живому організмі просто співають, звучать на тій чи іншій ноті: адже це інтервал звукових частот. Прихильники цієї гіпотези вважають навіть, що з часом вдасться «слухати» молекули живого організму і по зміні звуку дізнаватися про початок хвороби.
Незважаючи на те, що клубки ферментів вібрують зі звуковою частотою, вони зберігають свою структуру: нитки білка як би зважені у просторі. Безліч сил утримує їх – і електричні, і електромагнітні, і просто магнітні, створювані атомом металу.
Використовувати атомні магнітні поля — поки мрія людини. В природі ж атомний магнітний вібратор вже існує майже стільки ж, скільки існує і життя. Це молекула ферменту. Можна припустити, що в центрі молекули атом металу — як би магніт, від якого відштовхуються маленькі магнітики, розкидані по білковим клубкам ниток. Молекула ферменту не тільки магнітний вібратор, але і складна обчислювальна машина: вона починає діяти, тільки зіткнувшись з певним субстратом.
Перш за все про постійний магніт, що сидить в центрі, про метал. Це лише один атом якогось важкого металу: міді, заліза, цинку, свинцю, кобальту, золота… Навколо атома металу утворюється потужне магнітне поле з напруженістю до 300 000 ерстед, правда, діє воно на невелику відстань, але, мабуть, цілком достатню, щоб в його зону потрапили всі відростки ферменту. Білкові ланцюги, як мініатюрні пружини з накладеними на них магнітиками, оточують метал. Отже, фермент готовий до реакції, всі його частини напружені, вони знаходяться в нестійкій рівновазі, яка відразу ж порушиться, варто тільки з’явитися «знайомій» йому молекулі. Американський дослідник Ж. П. Шанже вважає, що здатність ферменту «впізнавати» необхідні йому для реакції речовини набула досконалості шляхом природного відбору.
У живому організмі немає моментів, коли фермент в бездіяльності. Або майже немає. Гіпотетично все це можна уявити так. Перший ж рух зарядів білкових спіралей створює магнітне поле, яке взаємодіє з постійним магнітним полем атома металу. Переважання позитивних або негативних зарядів, в свою чергу, призводить до закручування або розкручування спіралі. Буде вся спіраль відкидатися від центру або притягатися до нього, залежить від переважаючого знака заряду, а отже, від порядку набору амінокислот в спіралі, тобто від генетичної інформації, закладеної у ферменті.
Відкинуті магнітним і електростатичним полем білкові ланцюги перестають розкручуватися. Тепер переважають сили скручування, всі заряди починають обертатися в іншу сторону, виникає магнітне поле з іншим напрямком. Спіраль з силою притягується, стискається і знову прагне розкрутитися. Все це злегка нагадує дитячу іграшку, коли в гудзик протягнуто кілька ниток. Якщо скрутити нитки і потягнути, гудзик почне обертатися і силою енергії знову закрутить нитки в протилежну сторону. Знову потягнути за нитки — гудзик знову почне обертатися.
Таким чином, фермент виступає як мікроскопічний вібратор, збудливий навколо себе середовище і прискорюючий реакції між речовинами в десятки і сотні тисяч раз. Але фермент не просто вібрує середовище, своєю мікровібрацією він як би притирає одну речовину з іншою. Після того, як він зробив свою справу, фермент звільняється, і починається все спочатку.
Досить молекулу ферменту позбавити атома металу, просто вирвати його звідти, як пульсація припиняється. Ще зовсім недавно білкові ланцюжки ферментативного клубка були напружені, ніби накачані повітрям, тепер вони злиплися, спали і мляво пливуть в рідині, здригаючись від безладних ударів молекул навколишнього середовища.
Така ж історія відбувається і з тими ферментами, що позбавлені власного атома металу, а використовують магнітне і електростатичне поле оточуючих їх іонів кальцію або магнію. Варто тільки видалити ці іони — і ферменти перестають працювати. Можливо, тут, вже на молекулярному рівні, лежить межа між живим і неживим. Одні молекули пульсують, інші нерухомі, безжиттєві.
Автор: Ю. Симаков.

